题目内容
9.A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系,该元素(用R表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.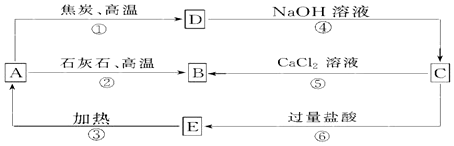
请回答下列问题:
(1)写出各物质的化学式:ASiO2;BCaSiO3;CNa2SiO3;DSi;EH2SiO3.
(2)写出反应①的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,该反应中氧化剂与还原剂的物质的量之比为1:2.
(3)写出反应④的离子方程式:Si+2OH-+H2O═SiO32-+2H2↑.
(4)写出反应⑤的离子方程式:SiO32-+Ca2+=CaSiO3↓.
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:SiO32-+CO2+H2O═H2SiO3↓+CO32-.
分析 非金属单质R能与NaOH溶液反应生成盐(Na2RO3)和氢气,则R为Si元素,由转化关系可知D为Si,A为SiO2,B为CaSiO3,C为Na2SiO3,E为H2SiO3,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)由以上分析可知A为SiO2,B为CaSiO3,C为Na2SiO3,D为Si,E为H2SiO3,故答案为:SiO2;CaSiO3;Na2SiO3;Si;H2SiO3;
(2)反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,根据方程式可知,该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO;1:2;
(3)反应④的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑,故答案为:Si+2OH-+H2O═SiO32-+2H2↑;
(4)反应⑤的离子方程式为SiO32-+Ca2+=CaSiO3↓,故答案为:SiO32-+Ca2+═CaSiO3↓;
(5)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:SiO32-+CO2+H2O═H2SiO3↓+CO32-.
点评 本题以硅为载体考查了无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,根据硅、二氧化硅、硅酸盐之间的转化关系来分析解答,注意:二氧化硅和碳在高温下反应生成CO而不是二氧化碳,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.298K时,向体积均为15.0mL、浓度均为1.00moL/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示.下列有关叙述正确的是( )

| A. | 两个滴定过程均可选择酚酞作指示剂 | |
| B. | 曲线a是NaHCO3溶液的滴定曲线 | |
| C. | 当V(盐酸)=4.00mol/L时,c(HCO3-)>c(NH4+)>c(CO32-) | |
| D. | 当V(盐酸)=15.00mol/L时,c(Na+)=c(NH4+) |
1.除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤;
②加过量NaOH溶液;
③加适量盐酸;
④加过量Na2CO3溶液;
⑤加过量BaCl2溶液.
①过滤;
②加过量NaOH溶液;
③加适量盐酸;
④加过量Na2CO3溶液;
⑤加过量BaCl2溶液.
| A. | ⑤②④①③ | B. | ①④②⑤③ | C. | ④②⑤ | D. | ④①②⑤③ |
18.下列溶液中有关物质的量浓度关系正确的是( )
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6 mol•L-1 | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液,c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) | |
| D. | 0.1 mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
19.下列溶液中,只用试管和胶头滴管,不用其他任何试剂就可鉴别的是( )
| A. | KOH和Al2(SO4)3 | B. | Ca(OH)2溶液和NaHCO3 | ||
| C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |