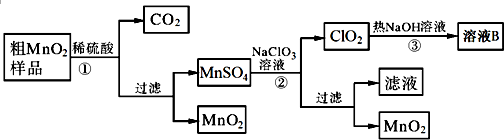
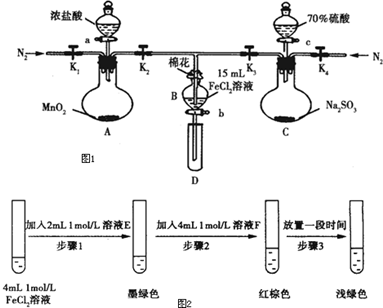
题目内容
据下表信息,判断以下叙述正确的是( )
| 部分短周期元素的原子半径及主要化合价 | ||||||
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
| A、GOH溶液和M(OH)3可以相互反应 |
| B、非金属性:T<Q |
| C、气态氢化物的稳定性:R>T |
| D、L2+与T2-核外电子数相等 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素;T和Q的最低化合价相同,应位于相同主族,且Q原子半径较大,可知Q为S元素;R有+5、-3价,处于ⅤA族,原子半径小于S,故R为N元素;G、L、M的化合价分别为+1、+2、+3,原子半径依次减小,均大于S原子半径,应处于第三周期,可推知G、L、M元素则分别为Na、Mg、Al,结合元素单质化合物的性质以及元素周期律解答.
解答:
解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素;T和Q的最低化合价相同,应位于相同主族,且Q原子半径较大,可知Q为S元素;R有+5、-3价,处于ⅤA族,原子半径小于S,故R为N元素;G、L、M的化合价分别为+1、+2、+3,原子半径依次减小,均大于S原子半径,应处于第三周期,可推知G、L、M元素则分别为Na、Mg、Al,
A.NaOH溶液和Al(OH)3可以相互反应生成偏铝酸钠与水,故A正确;
B.同主族自上而下非金属性减弱,O的非金属性强于S元素,故B错误;
C.O的非金属性强于N元素,所以对应的氢化物稳定性较稳定,故C错误;
D.Mg2+与O2-离子核外电子数都是10,故D正确,
故选AD.
A.NaOH溶液和Al(OH)3可以相互反应生成偏铝酸钠与水,故A正确;
B.同主族自上而下非金属性减弱,O的非金属性强于S元素,故B错误;
C.O的非金属性强于N元素,所以对应的氢化物稳定性较稳定,故C错误;
D.Mg2+与O2-离子核外电子数都是10,故D正确,
故选AD.
点评:本题考查元素周期表和元素周期律的基础知识,利用原子半径及化合价来推断出元素是解答本题的关键,难度不大.

练习册系列答案
相关题目
下列元素中,不属于主族元素的是( )
| A、磷 | B、钙 | C、铁 | D、溴 |
下列离子方程式书写正确的是( )
| A、向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O |
| B、Cu片插入FeCl3溶液中:Cu+Fe3+═Fe2++Cu2+ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、向 NaHSO4溶液中滴加Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
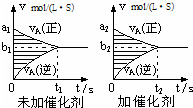 对于可逆反应mA(g)+nB(g)?pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象.下列判断正确的是( )
对于可逆反应mA(g)+nB(g)?pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象.下列判断正确的是( )| A、b1>b2,t1>t2 |
| B、两图中阴影部分面积一定相等 |
| C、A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率 |
| D、若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
化学与生活密切相关.下列情况会对人体健康造成较大危害的是( )
| A、用于消化道检查的钡餐(硫酸钡) |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D、用小苏打(NaHCO3)发酵面团制作馒头 |
下列离子方程式书写正确的是( )
| A、少量CO2通入Ba(OH)2溶液中:CO2+2OH-═CO32-+H2O |
| B、NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓ |
| C、FeCl3溶液腐蚀铜线路板:Fe3++Cu═Fe2++Cu2+ |
| D、向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3-+OH-═CO32-+H2O |
下列关于化学键的说法中不正确的是( )
| A、化学键是一种作用力 |
| B、化学键可以使离子相结合,也可以使原子相结合 |
| C、分子间作用力又称范德华力,它属于化学键 |
| D、化学反应过程中,反应物分子内的化学键断裂,生成物分子中的化学键形成 |