题目内容
4.下列反应中,加入氧化剂才能实现的是( )| A. | CO32-→CO2 | B. | HCl→Cl2 | C. | Cl2→HCl | D. | KMnO4→MnO2 |
分析 需加入氧化剂才能实现,则选项中为还原剂发生的变化,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.元素的化合价不变,不是氧化还原反应,故A错误;
B.Cl元素化合价升高,发生氧化反应,需要加入氧化剂才能实现,故B正确;
C.Cl元素的化合价降低,发生还原反应,需要加入还原剂才能实现,故C错误;
D.Mn元素化合价降低,被还原,可分解或加入还原剂,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重考查基本概念,明确元素化合价变化与氧化剂、还原剂关系即可解答,熟悉常见元素化合价,题目难度不大.

练习册系列答案
相关题目
19.材料是人类社会文明的支柱之一.人们一般将常见的材料分为金属材料、无机非金属材料、合成高分子材料及复合材料等四类.日常生活中常见的玻璃、陶瓷、水泥属于( )
| A. | 金属材料 | B. | 复合材料 | C. | 无机非金属材料 | D. | 合成高分子材料 |
12.化学与生产和生活密切相关,下列有关说法错误的是( )
| A. | 屠呦呦发现抗疟新药青蒿素而获得诺贝尔奖 | |
| B. | 氯气用作自来水的杀菌消毒剂 | |
| C. | 医用消毒酒精中乙醇的浓度(体积分数)为95% | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
9.下列说法正确的是( )
| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
16.取浓度相等的NaOH和HCl溶液,以体积比为3:2的比例相混和,所得溶液中的c(OH-)=0.01mol/L,则原溶液中溶质的物质的量浓度为( )
| A. | 0.01 mol/L | B. | 0.015 mol/L | C. | 0.017 mol/L | D. | 0.05 mol/L |
13.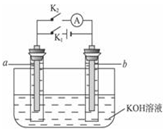 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| B. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| C. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
 ;写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
;写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.