题目内容
 如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:(1)惰性电极Ⅰ为电解池的
(2)反应开始一段时间后,惰性电极Ⅰ上实验现象为
(3)惰性电极Ⅱ上发生的电极反应为
(4)该电解反应方程式为
(5)可以将惰性电极Ⅰ换为
A.铜棒 B.铁棒 C.钠块.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由装置图可知KI淀粉溶液可用于检验氯气,Ⅱ为阳极,生成氯气,电极方程式为2Cl--2e-=Cl2↑,进而发生Cl2+2KI=2KCl+I2,Ⅰ为阴极,发生还原反应生成铜,以此解答该题.
解答:
解:(1)由装置图可知KI淀粉溶液可用于检验氯气,则Ⅱ为阳极,Ⅰ为阴极,在故答案为:阴;
(2)反应开始一段时间后,Ⅰ为阴极,发生还原反应生成铜,可观察到析出红色物质,Ⅱ为阳极,生成氯气,电极方程式为2Cl--2e-=Cl2↑,进而发生Cl2+2KI=2KCl+I2,可观察到KI-淀粉溶液会变蓝色,
故答案为:析出红色物质;蓝;
(3)惰性电极Ⅱ为阳极,发生的电极反应为2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑;
(4)电解氯化铜,阳极生成氯气,阴极析出铜,电解总方程式为CuCl2
Cu+Cl2↑ 或 Cu2++2Cl-
Cu+Cl2↑,
故答案为:CuCl2
Cu+Cl2↑ 或 Cu2++2Cl-
Cu+Cl2↑;
(5)Ⅰ为阴极,可为铁、铜等金属,由于钠的性质活泼,与水剧烈反应,则不能用钠作阴极,故答案为:AB.
(2)反应开始一段时间后,Ⅰ为阴极,发生还原反应生成铜,可观察到析出红色物质,Ⅱ为阳极,生成氯气,电极方程式为2Cl--2e-=Cl2↑,进而发生Cl2+2KI=2KCl+I2,可观察到KI-淀粉溶液会变蓝色,
故答案为:析出红色物质;蓝;
(3)惰性电极Ⅱ为阳极,发生的电极反应为2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑;
(4)电解氯化铜,阳极生成氯气,阴极析出铜,电解总方程式为CuCl2
| ||
| ||
故答案为:CuCl2
| ||
| ||
(5)Ⅰ为阴极,可为铁、铜等金属,由于钠的性质活泼,与水剧烈反应,则不能用钠作阴极,故答案为:AB.
点评:本题考查综合考查电化学知识,侧重于电解的原理和考查与应用,为高考常见题型和高频考点,注意把握电极方程式的书写,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4═Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A、一定产生BaSO4沉淀 |
| B、一定产生BaSO3沉淀 |
| C、一定有BaSO4沉淀 和BaSO3沉淀 |
| D、一定有SO3逸出 |
实验室制取下列气体的实验正确的是( )
A、 实验室制氯气 |
B、 实验室制氧气 |
C、 实验室制氨气 |
D、 实验室制二氧化碳 |
核电荷数小于18的某元素X,某原子核外电子层数为a,最外层电子数为(2a+1),下列有关元素X的说法中,不正确的是( )
| A、元素X的原子核内质子数为(2a2-1) |
| B、元素X的原子半径一定小于钠的原子半径 |
| C、由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
| D、元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) |
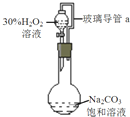 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验: