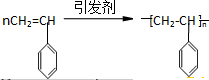
题目内容
14.下列关于反应能量的说法正确的是( )| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
分析 A.反应物总能量>生成物总能量,为放热反应;
B.形成化学键释放能量;
C.H2的燃烧热为1mol氢气完全燃烧放出的能量;
D.氢氧化钠固体溶于水放出热量.
解答 解:A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,为放热反应,则反应物总能量>生成物总能量,故A正确;
B.形成化学键释放能量,则2E1>E2,故B错误;
C.H2的燃烧热为1mol氢气完全燃烧放出的能量,H2的燃烧热为285.8kJ•mol-1,故C错误;
D.氢氧化钠固体溶于水放出热量,1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出的热量大于57.3 kJ,故D错误.
故选A.
点评 本题综合考查反应热与焓变等知识,为高考常见题型,侧重于学生分析能力的考查,考查的侧重点较为基础,有利于培养学生学习的积极性,注意反应热与键能的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.如表为元素周期表的一部分.
请回答下列问题:
(1)Z元素在周期表中的位置为第三周期ⅤⅡA族.
(2)表中元素原子半径最大的非金属是(元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为C3H4.
(5)向氯化铝溶液中加入过量氨水,离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+.
(6)将SO2通入稀硝酸中,反应的离子方程式为3SO2+2H2O+2NO3-═3SO42-+2NO↑+4H+.
| 碳 | 氮 | Y | ||
| 铝 | X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期ⅤⅡA族.
(2)表中元素原子半径最大的非金属是(元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为C3H4.
(5)向氯化铝溶液中加入过量氨水,离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+.
(6)将SO2通入稀硝酸中,反应的离子方程式为3SO2+2H2O+2NO3-═3SO42-+2NO↑+4H+.
5.常温下某溶液中,由水电离出的c(H+)为1×10-12mol/L,该溶液中一定不能大量共存的离子组是( )
| A. | Fe2+、Na+、SO42-、NO3- | B. | Na+、K+、Al3+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO42- |
9.已知某化学实验的结果如表:
下列结论正确的是( )
| 实验序号 | 反应物 | 在相同温度下测得的反应速率v/mol•L-1•min-1 | |
| 大小相同的金属片 | 酸溶液 | ||
| 1 | 镁条 | 1 mol•L-1盐酸 | v1 |
| 2 | 铁片 | 1 mol•L-1盐酸 | v2 |
| 3 | 铁片 | 0.1 mol•L-1盐酸 | v3 |
| A. | v1>v2>v3 | B. | v3>v2>v1 | C. | v1>v3>v2 | D. | v2>v3>v1 |
19.在11g某化合物X2S中.含S2-离子3.2g.则X的相对原子质量为( )
| A. | 23 | B. | 24 | C. | 39 | D. | 40 |
6.下列实验操作正确的是( )
| A. | 蒸发:应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏:开始蒸馏时应先加热再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 | |
| C. | 分液:下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯 | |
| D. | 量取:用规格为10mL的量筒量取8.0mL液体 |
4.在一个10L的密闭容器发生反应A(g)+B(g)?C(g)+D(g),测得平衡常数和温度的关系如表:
回答下列问题:
(1)△H< 0(填“<”或“>”).
(2)830℃时,向一个10L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5mol,则A的平衡转化率为50%,
②该温度下平衡常数K=1.
(3)判断该反应是否达到平衡的依据为ad
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数为2.5.
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
(1)△H< 0(填“<”或“>”).
(2)830℃时,向一个10L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5mol,则A的平衡转化率为50%,
②该温度下平衡常数K=1.
(3)判断该反应是否达到平衡的依据为ad
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数为2.5.