题目内容
12. 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段表示电解水 | |
| D. | CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+ |
分析 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解顺序为先电解氯化铜,再电解硫酸铜,最后电解水.设CuSO4的和NaCl各nmol,电解分3个阶段:
AB段:阳极:nmol氯离子失nmol电子,阴极:$\frac{1}{2}$nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极:nmol氢氧根离子失nmol电子(来源于水的电离),阴极:$\frac{1}{2}$nmol铜离子再得nmol电子,由于氢氧根离子消耗,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极:氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,溶液中氢离子浓度逐渐增大,pH值减小,
根据以上分析进行判断.
解答 解:设CuSO4的和NaCl各nmol,电解分3个阶段:
AB段:阳极:nmol氯离子失nmol电子,阴极:$\frac{1}{2}$nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极:nmol氢氧根离子失nmol电子(来源于水的电离),阴极:$\frac{1}{2}$nmol铜离子再得nmol电子,由于氢氧根离子消耗,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极:氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,溶液中氢离子浓度逐渐增大,pH值减小,
A、电解开始时,阳极先发生2Cl--2e-═Cl2↑,后发生4OH--4e-═2H2O+O2↑,阴极反应先发生Cu2++2e-═Cu,后发生2H++2e-═H2↑,故A错误;
B、BC段阳极发生的电极反应是:4OH--4e-═2H2O+O2↑,阴极铜离子得到电子,生成铜单质,故B错误;
C、CD段:阳极:氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,故C正确;
D、CD段发生2H++2e-═H2↑、4OH--4e-═2H2O+O2↑,即CD段电解的物质是水,故D错误;
故选:C.
点评 本题考查电解原理,明确电解过程中离子的移动及离子的放电顺序、发生的电极反应是解答本题的关键,并注意结合图象来分析解答,题目难度中等.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案| A. | 32g氧气与足量锂完全反应得到的电子数为2NA | |
| B. | 在1L2mol•L-1MgCl2溶液中含有的Cl-数为2NA | |
| C. | 标准状态下,2.24LCO2与2.24LH2O中所含原子数均为0.3NA | |
| D. | 标准状况下,11.2L氯气与足量NaOH溶液反应转移的电子数为0.5NA |
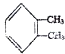 ,按系统命名法命名,下列命名正确的是(
,按系统命名法命名,下列命名正确的是(| A. | 对二甲苯 | B. | 1,6-二甲苯 | C. | 1,2-二甲苯 | D. | 乙苯 |

| A. | n(Cl2)、n(HClO)和n(ClO-)之和不随pH变化而变化 | |
| B. | 当pH逐渐增大时,HClO先增大后减小 | |
| C. | 当pH>8.5时,c(H+)=c(OH-)+c(ClO-)+c(Cl-) | |
| D. | K1、K2均是通过曲线交点计算得出的酸的电离平衡常数 |
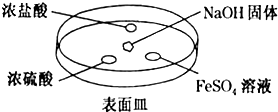

 已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D
;D .
.
 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH. 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是