题目内容
18.短周期主族元素X、Y、Z、W原子序数依次增大,X的某种单质是一种粮仓中常用的粮食保护气,Y和Z原子的最外层电子数之和等于W原子的最外层电子数,Z原子核外电子数是W原子最外层电子数的2倍.下列说法正确的是( )| A. | 原子半径:r(Y)<r(X)<r(W)<r(Z) | |
| B. | 元素Z的最高价含氧酸的酸性比W的强 | |
| C. | 元素Y、W的离子具有相同的电子层结构 | |
| D. | Z的简单气态氢化物的热稳定性比W的弱 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,X的某种单质是一种粮仓中常用的粮食保护气,X为N元素;Y和Z原子的最外层电子数之和等于W原子的最外层电子数,Z原子核外电子数是W原子最外层电子数的2倍,设W的最外层电子数为x,则Z的核外电子数为2x,Y的最外层电子数为x-(2x-10)=10-x,若x=7,则Z为Si,Y为Al,W为Cl符合题意;若x=6,Z为Mg,Y为C或Si均不符合原子序数增大,以此来解答.
解答 解:由上述分析可知,X为N,Y为Al,Z为Si,W为Cl,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:r(X)<r(W)<r(Z)<r(Y),故A错误;
B.非金属性W>Z,则元素Z的最高价含氧酸的酸性比W的弱,故B错误;
C.元素Y、W的离子相差1个电子层,故C错误;
D.非金属性W>Z,则Z的简单气态氢化物的热稳定性比W的弱,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
8.在某恒温、恒容的密闭容器内发生反应:2NO2(g)?2NO(g)+O2(g)△H>0,开始时充入2molNO2并达到平衡,下列说法正确的是( )
| A. | 再充入2molNO2,平衡正向移动,O2的体积分数增大 | |
| B. | 升高温度,O2的体积分数减小 | |
| C. | 充入N2,平衡不移动 | |
| D. | 再充入1molO2,NO2的体积分数增大 |
9.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明 Cl2的氧化性强于 I2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2 有漂白性 | |
| C. | 向氯水中滴加硝酸酸化的 AgNO 溶液,产生白色沉淀,说明氯水中含有 Cl- | |
| D. | 向氯水中加入 NaHCO 粉末,有气泡产生,说明氯水中含有 H+ |
6.在自然界中既能以游离态存在又能以化合态存在的元素是( )
| A. | 铝 | B. | 硅 | C. | 硫 | D. | 氯 |
13.下列过程吸收热量的是( )
| A. | 钠和水反应 | B. | 铝热反应 | C. | 液氨气化 | D. | 镁条燃烧 |
3.由合成气制备二甲醚的主要原理如下.下列有关说法正确的是( )
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1.
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1.
| A. | 升高温度能加快反应②的化学反应速率,提高CH3OCH3产率 | |
| B. | 反应③使用催化剂,△H3减少 | |
| C. | 反应 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.lkJ•mol-1 | |
| D. | 反应③对反应②无影响 |
10.明矾是一种常用的净水剂,明矾不属于( )
| A. | 盐 | B. | 化合物 | C. | 混合物 | D. | 硫酸盐 |
7.五倍子是一种常见的中草药,其有效成分为X.在一定条件下X可分别转化为Y、Z.
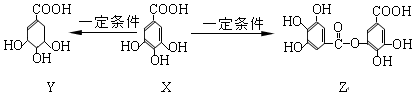
下列说法错误的是( )

下列说法错误的是( )
| A. | 1molZ最多能与7molNaOH发生反应 | |
| B. | 1molX最多能与2molBr2发生取代反应 | |
| C. | Y分子结构中有3个手性碳原子 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
3.下列说法正确的是( )
| A. | 水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀 | |
| B. | 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用 | |
| C. | H2O2分解产生标准状况下22.4 L O2,理论上转移电子数约为4×6.02×1023 | |
| D. | 常温下pH=3的盐酸与pH=11的某碱溶液等体积混合,若溶液呈碱性,该碱为弱碱 |