题目内容
某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成.依次进行下列五步实验,观察到的现象记录如下:
①混合物加水得无色透明溶液;
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成.将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;(已知:Cl2+2KI=2KCl+I2)
⑤将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.
根据以上实验,可以判断出混合物中
(1)肯定含有 .
(2)不能确定是否含有 .
(3)一定不含有 .
(4)写出第③步中反应的离子方程式: .
①混合物加水得无色透明溶液;
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成.将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;(已知:Cl2+2KI=2KCl+I2)
⑤将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.
根据以上实验,可以判断出混合物中
(1)肯定含有
(2)不能确定是否含有
(3)一定不含有
(4)写出第③步中反应的离子方程式:
考点:几组未知物的检验
专题:物质检验鉴别题
分析:①向混合物中加入适量水全部溶解,溶液无色透明,说明一定不会含有CuCl2,不含有不溶物或反应生成不溶物;
②向步骤①溶液中滴加BaCl2溶液生成白色沉淀,则说明该白色沉淀是碳酸钡或是硫酸钡中的至少一种;
③取步骤②的白色沉淀,白色沉淀可完全溶于稀盐酸,说明该沉淀不会是硫酸钡,所以一定是碳酸钡;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层呈无色,则一定没有碘单质生成,所以可以确定KI一定不存在;
⑤另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,说明该白色沉淀一定是氯化银,但无法证明该溶液中的氯离子,是来自于原混合物还是②中加入的氯化钡所致,以此来解答.
②向步骤①溶液中滴加BaCl2溶液生成白色沉淀,则说明该白色沉淀是碳酸钡或是硫酸钡中的至少一种;
③取步骤②的白色沉淀,白色沉淀可完全溶于稀盐酸,说明该沉淀不会是硫酸钡,所以一定是碳酸钡;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层呈无色,则一定没有碘单质生成,所以可以确定KI一定不存在;
⑤另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,说明该白色沉淀一定是氯化银,但无法证明该溶液中的氯离子,是来自于原混合物还是②中加入的氯化钡所致,以此来解答.
解答:
解:由信息可知,①确定一定不含CuCl2,因CuCl2溶于水为蓝色;
由②③可知,一定含Na2CO3,不含K2SO4、CaCl2,
由④可知,一定不含KI;
由⑤可知白色沉淀为AgCl,但②中引入氯离子,则不能确定是否含NaCl,
上述信息不能确定KNO3是否存在,
综上所述,混合物中肯定含有碳酸钠,一定不含有K2SO4、KI、CuCl2、CaCl2,可能含有NaCl、KNO3、KCl;
(1)混合物中肯定含有碳酸钠,故答案为:Na2CO3;
(2)对于是否含有NaCl、KNO3、KCl;不能确定,故答案为:NaCl、KNO3、KCl;
(3)一定不含有K2SO4、KI、CuCl2、CaCl2,故答案为:K2SO4、KI、CuCl2、CaCl2;
(4)碳酸钡完全溶于盐酸中,生成氯化钡、水以及二氧化碳,即BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O.
由②③可知,一定含Na2CO3,不含K2SO4、CaCl2,
由④可知,一定不含KI;
由⑤可知白色沉淀为AgCl,但②中引入氯离子,则不能确定是否含NaCl,
上述信息不能确定KNO3是否存在,
综上所述,混合物中肯定含有碳酸钠,一定不含有K2SO4、KI、CuCl2、CaCl2,可能含有NaCl、KNO3、KCl;
(1)混合物中肯定含有碳酸钠,故答案为:Na2CO3;
(2)对于是否含有NaCl、KNO3、KCl;不能确定,故答案为:NaCl、KNO3、KCl;
(3)一定不含有K2SO4、KI、CuCl2、CaCl2,故答案为:K2SO4、KI、CuCl2、CaCl2;
(4)碳酸钡完全溶于盐酸中,生成氯化钡、水以及二氧化碳,即BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O.
点评:本题考查无机物的推断,为高频考点,把握白色沉淀的成分及确定一定含碳酸钠为解答的关键,侧重物质性质及发生反应的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将2mol SO2和2mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)?2SO3(g),平衡时SO3为W mol.相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、3 mol SO2+1 mol SO3 |
胶体分散系与其它分散系的本质差别是( )
| A、分散质粒子是否带电 |
| B、是否有丁达尔现象 |
| C、是否稳定 |
| D、分散质直径大小 |
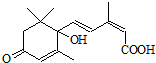 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )| A、其分子中含有一个手性碳原子 |
| B、只能发生加聚反应,不能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
将氯化钠、乙醇、碘分别从以下三种混合物中分离出来,①食盐水②乙醇溶液③碘水( )
| A、蒸馏、萃取、蒸发 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸发、蒸馏、萃取 |
下列从海水中提取镁正确的方法是( )(提示:熔点:MgO2 850℃MgCl2 714℃)
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
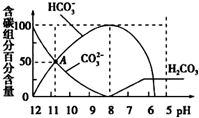 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、当加入20 mL盐酸时,混合溶液的pH约为8 |
分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A、15种 | B、16种 |
| C、17种 | D、18种 |