题目内容
9.常温下,下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) | |
| C. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| D. | 向0.10mol•L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
分析 A.盐的水解程度较小,则醋酸根离子浓度最大,钠离子的浓度大于铵根离子;
B.反应后溶液可以看作NH4Cl、NaHCO3的混合液,根据混合液中的物料守恒和电荷守恒判断;
C.反应后溶液的pH=7,则c(H+)=c(0H-),由电荷守恒可知:c(Na+)=c(ClO-)+c(Cl-),反应后溶质为NaCl、NaClO、HClO,由Cl2+H2O?HClO+HCl可知,c(Cl-)=c(ClO-)+c(HClO),则c(Cl-)>c(ClO-);
D.反应后溶质为碳酸钠和碳酸氢钠的混合物,结合碳酸钠溶液中的质子守恒分析.
解答 解:A.将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合,由于盐的水解程度较小,则:c(CH3COO-)>c(Na+)>c(NH4+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-),故A正确;
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,可以看作为NH4Cl、NaHCO3的混合液,析出部分NaHCO3晶体后,根据物料守恒可得:c(Cl-)=c(NH4+)+c(NH3•H2O)、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),物料守恒和电荷守恒结合可得:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O),故B正确;
C.在饱和氯水中加入NaOH使pH=7,c(H+)=c(0H-),由电荷守恒可知,c(Na+)=c(ClO-)+c(Cl-),反应后溶质为NaCl、NaClO、HClO,由Cl2+H2O?HClO+HCl可知,c(Cl-)=c(ClO-)+c(HClO),则c(Cl-)>c(ClO-),溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(ClO-)>c(HClO),故C错误;
D.0.10mol•L-1 Na2CO3溶液中通入少量CO2的溶液中,碳酸钠溶液中满足c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),而通入二氧化碳气体后氢氧根离子浓度减小,碳酸氢根离子离子浓度增大,则c(OH-)<c(H+)+c(HCO3-)+2c(H2CO3),故D错误;
故选AB.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,分散在空气中不可能形成胶体 | |
| B. | 生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品 | |
| C. | 食品添加剂对人体均有益,可随意使用 | |
| D. | 洪涝、地震灾区灾后可用石灰消毒,是利用石灰可使蛋白质变性的性质 |
| A. | PH=12的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变红色的溶液:Na+、Al3+、NO3-、SO42- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、SO42- |
| A. | 硅的原子结构示意图: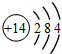 | B. | 乙烯分子比例模型: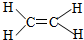 | ||
| C. | 次氯酸分子的电子式: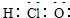 | D. | 乙酸分子的结构简式:C2H4O2 |
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
| A. | 1:6 | B. | 2:15 | C. | 2:11 | D. | 1:7 |
| A. | m=4 R2+是还原剂 | B. | m=n R3+是氧化产物 | ||
| C. | m=2 R2+是氧化剂 | D. | m=y R3+是还原产物 |
| A. | 氧化剂是Cl2 | |
| B. | 氧化剂与还原剂的物质的量之比为3:8 | |
| C. | 每生成1molN2,转移3mol电子 | |
| D. | 被氧化与未被氧化的NH3物质的量之比为1:3 |
| A. | 物质的量就是物质的质量 | |
| B. | 氧气的摩尔质量为32g | |
| C. | 摩尔是国际单位制的七大基本物理量之一 | |
| D. | 同温同压下,分子数相同的任何气体体积相同 |