题目内容
共价键、离子键和分子间作用力是微粒之间的三种作用力.下列晶体①Ba(OH)2②SiO2③金刚石④KCl ⑤干冰中,含有两种作用力的是( )
| A、①②③ | B、①⑤ |
| C、②④⑤ | D、②③④ |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答:
解:①Ba(OH)2中钡离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,故正确;
②SiO2中Si原子和O原子之间只存在共价键,故错误;
③金刚石中碳原子之间只存在共价键,故错误;
④KCl中钾离子和氯离子之间只存在离子键,故错误;
⑤干冰中存在极性键、分子间作用力,故正确;
故选B.
②SiO2中Si原子和O原子之间只存在共价键,故错误;
③金刚石中碳原子之间只存在共价键,故错误;
④KCl中钾离子和氯离子之间只存在离子键,故错误;
⑤干冰中存在极性键、分子间作用力,故正确;
故选B.
点评:本题考查了化学键和分子间作用力,明确物质的构成微粒是解本题关键,根据晶体类型及微粒间的作用力分析解答,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH═CH2 ③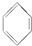 ④CH3CH3.
④CH3CH3.
①SO2 ②CH3CH2CH═CH2 ③
 ④CH3CH3.
④CH3CH3.| A、①②③④ | B、③④ |
| C、①②④ | D、①② |
用0.2mol/L的Na2SO3溶液60mL,恰好将4×10-3mol XO4-还原,则元素X在还原产物中的化合价是( )
| A、+4 | B、+3 | C、+2 | D、+1 |
下列叙述不正确的是( )
| A、根据能量守定律可知,反应物的总能量等于生成物的总能量 |
| B、酸碱中和反应是放热的 |
| C、氢氧化钡晶体与氯化铵固体反应是吸热的 |
| D、化学能可以转化为热能、电能、光能等 |
水的电离过程为H2O?H++OH-,在25℃时,水的离子积:KW=1×10-14,在35℃时,水的离子积:KW(35℃)=2.1×10-14,则下列叙述正确的是( )
| A、c(H+)随着温度的升高而降低 |
| B、35℃时,c(H+)<c(OH-) |
| C、35℃时的水比25℃时的水电离程度小 |
| D、水的电离是吸热的 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、11.2L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为11NA |
| C、常温常压下32g O2与O3的混合物含有的氧原子数为2NA |
| D、0.5mol/LH2SO4中的H+数为NA |
下列物质分类中,前者包括后者的是( )
| A、氧化物、酸性氧化物 |
| B、含氧酸、酸 |
| C、碱性氧化物、碱 |
| D、酸式盐、盐 |