题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物.请填写下列空白:
(1)D元素形成的简单离子的结构示意图为 ,丙物质的化学式为 ,丁物质中阴离子与阳离子的个数之比为 .
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 .
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为 .
(4)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则戊与己按物质的量3:4反应后溶液中溶质为 .
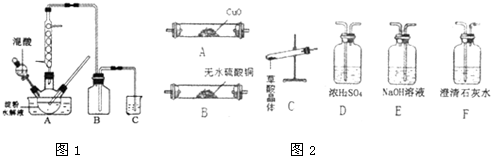
(5)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
①写出ⅰ中通入该物质这一极的电极反应式 .
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的H+浓度约为 .

| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B.C | A.C | A.D | C.D |
(1)D元素形成的简单离子的结构示意图为
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为
(4)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则戊与己按物质的量3:4反应后溶液中溶质为
(5)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
①写出ⅰ中通入该物质这一极的电极反应式
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式

考点:位置结构性质的相互关系应用,原电池和电解池的工作原理
专题:基本概念与基本理论
分析:A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、D为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2,B、C形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为CO,则B为C元素,据此解答.
解答:
解:A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、D为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2,B、C形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为CO,则B为C元素,
(1)D为Na元素, ,由上述分析可知,丙为NaH,丁为Na2O2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2;
,由上述分析可知,丙为NaH,丁为Na2O2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2;
故答案为: ;NaH;1:2;
;NaH;1:2;
(2)标准状况下5.6L CO完全燃烧生成稳定氧化物时放出的热量为QkJ,1molO完全燃烧放出的热量=QkJ×
=4QkJ,则CO燃烧热的热化学方程式为:CO(g)+
O2(g)=CO2 (g)△H=-4Q kJ/mol,
故答案为:CO(g)+
O2(g)=CO2 (g)△H=-4Q kJ/mol;
(3)研究表明H2O2物质具有弱酸性,则H2O2物质在水中的电离方程式为:H2O2?H++HO2-,
故答案为:H2O2?H++HO2-;
(4)B、C两种元素按原子个数比为1:2可形成化合物戊为CO2,A、C、D三种元素按原子个数比为1:1:1可形成化合物己为NaOH,如果CO2和NaOH按物质的量之比为1:2完全反应生成Na2CO3,如果CO2和NaOH按物质的量之比为1:1完全反应生成NaHCO3,现在CO2和NaOH按物质的量之比为3:4完全反应则生成溶液中含溶质为Na2CO3、NaHCO3,故答案为:Na2CO3、NaHCO3;
(5)某同学设计以CH3OH物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,
①ⅰ中通入甲醇一极为负极,碱性条件下生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②Fe为阴极,石墨为阳极,开始阳极生成的气体为氯气,阴极为铜离子放电生成Cu,氯离子放电完毕,水放电生成氧气,当溶液中铜离子放电完毕,实质为电解水,阴极是氢离子放电生成氢气,在0~t1阶段为电解氯化铜溶液,在t1~t2阶段为电解硫酸铜溶液,
故在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O (或2 H2O-4e-=O2↑+4 H+);
在t2时溶液中铜离子恰好放电完毕,t1~t2阶段生成氧气为336mL-224mL=112mL,其物质的量为
=0.005mol,由2 H2O-4e-=O2↑+4 H+可知,n(H+)=4n(O2)=0.005mol×4=0.02mol,则c(H+)=
=0.1mol/L,
故答案为:4OH--4e-=O2↑+2H2O (或2 H2O-4e-=O2↑+4 H+);0.1mol/L.
(1)D为Na元素,
 ,由上述分析可知,丙为NaH,丁为Na2O2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2;
,由上述分析可知,丙为NaH,丁为Na2O2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2;故答案为:
 ;NaH;1:2;
;NaH;1:2;(2)标准状况下5.6L CO完全燃烧生成稳定氧化物时放出的热量为QkJ,1molO完全燃烧放出的热量=QkJ×
| 1mol×22.4L/mol |
| 5.6L |
| 1 |
| 2 |
故答案为:CO(g)+
| 1 |
| 2 |
(3)研究表明H2O2物质具有弱酸性,则H2O2物质在水中的电离方程式为:H2O2?H++HO2-,
故答案为:H2O2?H++HO2-;
(4)B、C两种元素按原子个数比为1:2可形成化合物戊为CO2,A、C、D三种元素按原子个数比为1:1:1可形成化合物己为NaOH,如果CO2和NaOH按物质的量之比为1:2完全反应生成Na2CO3,如果CO2和NaOH按物质的量之比为1:1完全反应生成NaHCO3,现在CO2和NaOH按物质的量之比为3:4完全反应则生成溶液中含溶质为Na2CO3、NaHCO3,故答案为:Na2CO3、NaHCO3;
(5)某同学设计以CH3OH物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,
①ⅰ中通入甲醇一极为负极,碱性条件下生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②Fe为阴极,石墨为阳极,开始阳极生成的气体为氯气,阴极为铜离子放电生成Cu,氯离子放电完毕,水放电生成氧气,当溶液中铜离子放电完毕,实质为电解水,阴极是氢离子放电生成氢气,在0~t1阶段为电解氯化铜溶液,在t1~t2阶段为电解硫酸铜溶液,
故在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O (或2 H2O-4e-=O2↑+4 H+);
在t2时溶液中铜离子恰好放电完毕,t1~t2阶段生成氧气为336mL-224mL=112mL,其物质的量为
| 0.112L |
| 22.4L/mol |
| 0.02mol |
| 0.2L |
故答案为:4OH--4e-=O2↑+2H2O (或2 H2O-4e-=O2↑+4 H+);0.1mol/L.
点评:本题比较综合,涉及元素化合物推断、热化学方程式书写、原电池与电解原理、化学计算等,推断元素及物质是解题关键,需要学生熟练掌握基础知识,难度中等.

练习册系列答案
相关题目
决定1mol气体体积大小的主要因素是( )
| A、分子个数的多少 |
| B、分子间平均距离的大小 |
| C、分子直径的大小 |
| D、相对分子质量的大小 |
根据表提供的数据,下列判断正确的是( )
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A、同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 |
| B、结合H+ 的能力:ClO->CO32->F- |
| C、碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑ |
| D、次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O=HCO3-+HClO |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A、Na2B溶液中一定有:c(Na+)=2[c(B2-)+c(HB-)+c(H2B)] |
| B、Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性 |
| C、NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) |
| D、在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-) |
 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.