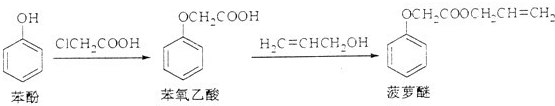
题目内容
黑火药是中国的“四大发明”之一,其爆炸时,发生如下的反应:2KNO3+3C+S═K2S+N2↑+3CO2↑.
(1)其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 ;
(2)用双线桥标出电子转移的方向和数目:2KNO3+3C+S═K2S+N2↑+3CO2↑
(3)当0.1molCO2生成时,则转移的电子数为 个.
(1)其中被还原的元素是
(2)用双线桥标出电子转移的方向和数目:2KNO3+3C+S═K2S+N2↑+3CO2↑
(3)当0.1molCO2生成时,则转移的电子数为
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N、S元素的化合价降低,C元素的化合价升高,含元素化合价降低的物质为氧化剂,氧化剂被还原,而含元素化合价升高的物质为还原剂,还原剂被氧化,对应的产物为氧化产物,结合化合价的变化计算转移电子数目.
解答:
解:(1)在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,
S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,被还原的元素为N、S,
C元素的化合价由0升高到+4,则C作还原剂,被氧化,对应的CO2为氧化产物,K2S和N2为还原产物,
故答案为:N 和S;C;KNO3和S;C;CO2;K2S和N2;
(2)该反应中转移电子数为4e-,则转移的电子方向和数目为 ,故答案为:
,故答案为: ;
;
(3)反应中C元素化合价由0价升高到+4价,当0.1molCO2生成时,转移电子0.4mol,则转移的电子数为0.4NA 或2.408×1023,故答案为:0.4NA 或2.408×1023.
S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,被还原的元素为N、S,
C元素的化合价由0升高到+4,则C作还原剂,被氧化,对应的CO2为氧化产物,K2S和N2为还原产物,
故答案为:N 和S;C;KNO3和S;C;CO2;K2S和N2;
(2)该反应中转移电子数为4e-,则转移的电子方向和数目为
 ,故答案为:
,故答案为: ;
;(3)反应中C元素化合价由0价升高到+4价,当0.1molCO2生成时,转移电子0.4mol,则转移的电子数为0.4NA 或2.408×1023,故答案为:0.4NA 或2.408×1023.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确元素的化合价的变化及氧化还原反应中的基本概念是解答本题的关键,难度不大.

练习册系列答案
相关题目
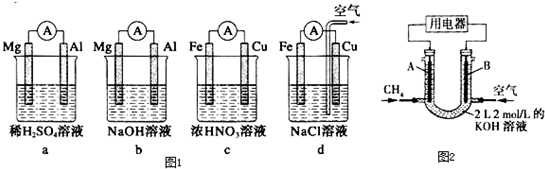
在恒温恒容容器中,2NO2?N2O4已达平衡状态.若①再加少量的NO2,②再加少量N2O4,重新达到平衡后,
NO2 的物质的量分数将( )
NO2 的物质的量分数将( )
| A、①中增大,②中减小 |
| B、①中减小 ②中增大 |
| C、①、②中都增大 |
| D、①、②中都减少 |
在元素周期表中,在金属元素和非金属元素分界线附近能找到什么材料( )
| A、催化剂 | B、半导体 |
| C、农药 | D、制冷剂 |

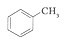 和
和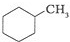 .其中互为同分异构体的是
.其中互为同分异构体的是 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).