题目内容
(1)分析如图1所示的四个装置,回答下列问题:
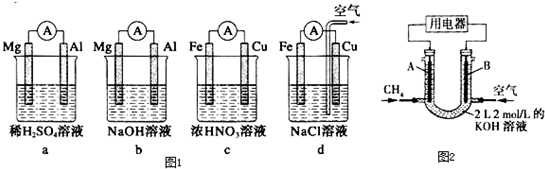
①装置a和b中铝电极上的电极反应式分别为:a中 ,b中
②装置c中产生气泡的电极为 电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为 .
(2)将CH4设计成燃料电池,其利用率更高,装置如图2所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
①0<V≤44.8L时,电池负极电极反应为 ;当消耗甲烷的体积为22.4L(标况下)时,转移电子的物质的量为 ;此时溶液中KOH的物质的量浓度为 ;(假设溶液体积不变)
②44.8L<V≤89.6L时,电池总反应方程式为 .

①装置a和b中铝电极上的电极反应式分别为:a中
②装置c中产生气泡的电极为
(2)将CH4设计成燃料电池,其利用率更高,装置如图2所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
①0<V≤44.8L时,电池负极电极反应为
②44.8L<V≤89.6L时,电池总反应方程式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)在稀H2SO4溶液中,镁比铝活泼,铝电极作正极,在NaOH溶液中,铝比镁活泼,铝电极作负极,;在浓硝酸中,铁被钝化,铁电极作正极,正极上发生NO3-的还原反应,产生气泡,装置d相当于金属铁发生吸氧腐蚀,铜电极作正极;
(2)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
(2)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
解答:
解:(1)①在稀H2SO4溶液中,镁比铝活泼,铝电极作正极,正极的电极反应式为2H++2e-═H2↑.在NaOH溶液中,铝比镁活泼,铝电极作负极,负极的电极反应式为Al-3e-+4OH-═AlO2-+2H2O,
故答案为:2H++2e-═H2↑;Al-3e-+4OH-═AlO2-+2H2O;
②在浓硝酸中,铁被钝化,铁电极作正极,正极上发生NO3-的还原反应,产生气泡,
装置d相当于金属铁发生吸氧腐蚀,铜电极作正极,正极的电极反应式为O2+2H2O+4e-═4OH-,
故答案为:铁;O2+2H2O+4e-═4OH-;
(2)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,当消耗甲烷的体积为22.4L(标况下)即1mol时,转移电子的物质的量为8mol,此时消耗的溶液中KOH的物质的量为2mol,剩余的氢氧化钾浓度为
=1mol/L.
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;8mol;1mol/L;
②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则总反应式为:CH4+2O2+K2CO3═2KHCO3+H2O,故答案为:CH4+2O2+K2CO3═2KHCO3+H2O.
故答案为:2H++2e-═H2↑;Al-3e-+4OH-═AlO2-+2H2O;
②在浓硝酸中,铁被钝化,铁电极作正极,正极上发生NO3-的还原反应,产生气泡,
装置d相当于金属铁发生吸氧腐蚀,铜电极作正极,正极的电极反应式为O2+2H2O+4e-═4OH-,
故答案为:铁;O2+2H2O+4e-═4OH-;
(2)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,当消耗甲烷的体积为22.4L(标况下)即1mol时,转移电子的物质的量为8mol,此时消耗的溶液中KOH的物质的量为2mol,剩余的氢氧化钾浓度为
| 4mol-2mol |
| 2L |
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;8mol;1mol/L;
②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则总反应式为:CH4+2O2+K2CO3═2KHCO3+H2O,故答案为:CH4+2O2+K2CO3═2KHCO3+H2O.
点评:本题考查了原电池、燃料电池、电解池的工作原理和规律等重要考点,涉及的知识点较多,综合性较强,难度较大.

练习册系列答案
相关题目
已知:H2(g)+F2(g)?2HF(g)△H=-270kJ/mol,下列说法正确的是( )
| A、2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量 |
| B、1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ |
| C、1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ |
| D、在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A、x=10-2y |
| B、x>y |
| C、x=y |
| D、x=102y |