题目内容
分类法在化学科学中起着非常重要的作用,下列各组物质中,在物质分类中,前者从属于后者的一组是
A.金属,化合物 B.金属氧化物,碱性氧化物
C.泥沙,胶体 D.单质,纯净物
练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
12.如图表示酸雨的形成,关于酸雨下列说法正确的是( )


| A. | 酸雨的PH为5.6 | |
| B. | 酸雨的形成过程发生了氧化还原反应 | |
| C. | 酸雨的主要成分为氮、硫元素的氧化物 | |
| D. | 形成酸雨的主要原因是因为雷雨天气 |
13.某元素R的最高正价与最低负价的代数和为0,由此可以判断( )
| A. | R原子核外一定有4个电子层 | |
| B. | R原子最外层电子数一定为4 | |
| C. | R的气态氧化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R元素气态氢化物的化学式为H2R |
8. “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)下列措施中,有利于降低大气中CO2浓度的有abc (填字母).
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△Hl=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H2=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放 (填“吸”或“放”)热反应.
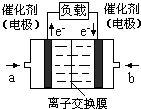
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是氧气(填“乙醇”或“氧气”),a处发生的电极反应是CH3CH2OH+16OH--12e-═2CO32-+11H2O.
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)下列措施中,有利于降低大气中CO2浓度的有abc (填字母).
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△Hl=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H2=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放 (填“吸”或“放”)热反应.
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是氧气(填“乙醇”或“氧气”),a处发生的电极反应是CH3CH2OH+16OH--12e-═2CO32-+11H2O.
8.1mol过氧化钠与2mol碳酸氢钾固体混合后,在密闭容器中加热至250℃充分反应,排出气体物质后冷却,残留的固体物质和排出的气体分别是( )
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |


 之比
之比