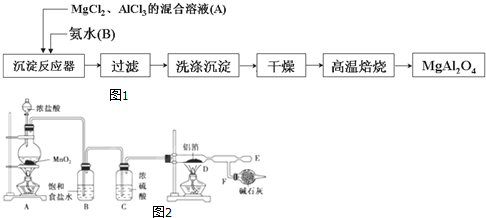
题目内容
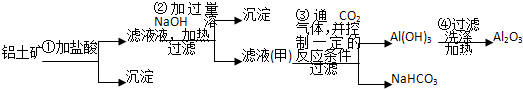
二氧化铈(CeO2)是一种重要的稀土氧化物.平板电视显示屏生产过程中产生大量的废玻璃粉末(主要含CeO2、SiO2、Fe2O3等).某课题组以此粉末为原料回收铈,设计实验流程如图:
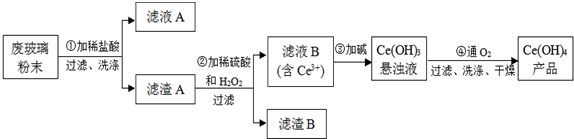
(1)洗涤滤渣A的主要目的是为了除去 (填离子符号).
(2)第②步反应的离子方程式为: ;滤渣B的主要成分是: .
(3)萃取是分离稀土元素的常用方法.已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶.实验室进行萃取操作时用到的主要玻璃仪器有: 、烧杯、玻璃棒、量筒等.
(4)取上述流程中得到的Ce(OH)4产品0.462g,加硫酸溶解后,用0.1000mol?L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗20.00mL标准溶液.该产品中Ce(OH)4的质量分数为: (小数点后保留两位有效数字).

(1)洗涤滤渣A的主要目的是为了除去
(2)第②步反应的离子方程式为:
(3)萃取是分离稀土元素的常用方法.已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP
(4)取上述流程中得到的Ce(OH)4产品0.462g,加硫酸溶解后,用0.1000mol?L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗20.00mL标准溶液.该产品中Ce(OH)4的质量分数为:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:废玻璃粉末中含有SiO2、Fe2O3、CeO2,向其中加入稀盐酸,Fe2O3反应变成FeCl3,溶于水,滤渣A的成分为SiO2、CeO2(第①步),第②步向滤渣A中加稀硫酸和H2O2,SiO2不反应,CeO2反应变成Ce3+,加碱以Ce(OH)3形式沉淀出(第③步),Ce(OH)3和氧气反,生成Ce(OH)4,经过滤、洗涤、干燥得到纯净的Ce(OH)4;
根据该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品;
(1)根据滤渣A上含有FeCl3;
(2)根据氧化还原反应中电子得失守恒来分析;滤渣B为SiO2;
(3)根据萃取剂与水不互溶的原则来回答,根据萃取实验的仪器:分液漏斗、烧杯、玻璃棒、量筒等来回答;
(4)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
根据该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品;
(1)根据滤渣A上含有FeCl3;
(2)根据氧化还原反应中电子得失守恒来分析;滤渣B为SiO2;
(3)根据萃取剂与水不互溶的原则来回答,根据萃取实验的仪器:分液漏斗、烧杯、玻璃棒、量筒等来回答;
(4)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
解答:
解:废玻璃粉末中含有SiO2、Fe2O3、CeO2,向其中加入稀盐酸,Fe2O3反应变成FeCl3,溶于水,滤渣A的成分为SiO2、CeO2(第①步),第②步向滤渣A中加稀硫酸和H2O2,SiO2不反应,CeO2反应变成Ce3+,加碱以Ce(OH)3形式沉淀出(第③步),Ce(OH)3和氧气反,生成Ce(OH)4,经过滤、洗涤、干燥得到纯净的Ce(OH)4;
(1)滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+;
(2)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;加入稀硫酸和H2O2,CeO2转化为Ce3+,SiO2不反应,滤渣B的成分为SiO2,
故答案为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;SiO2;
(3)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以TBP不能与水互溶,实验室进行萃取操作时用到的主要玻璃仪器有:分液漏斗、烧杯、玻璃棒、量筒等,故答案为:不能;分液漏斗;
(4)Ce(OH)4 ~FeSO4
0.0020mol 0.1000mol/L-1×0.020L
所以m(Ce(OH)4)=0.0020mol×208g/mol=0.416g,产品中Ce(OH)4的质量分数为
×100%=90.04%,
故答案为:90.04%;
(1)滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+;
(2)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;加入稀硫酸和H2O2,CeO2转化为Ce3+,SiO2不反应,滤渣B的成分为SiO2,
故答案为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;SiO2;
(3)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以TBP不能与水互溶,实验室进行萃取操作时用到的主要玻璃仪器有:分液漏斗、烧杯、玻璃棒、量筒等,故答案为:不能;分液漏斗;
(4)Ce(OH)4 ~FeSO4
0.0020mol 0.1000mol/L-1×0.020L
所以m(Ce(OH)4)=0.0020mol×208g/mol=0.416g,产品中Ce(OH)4的质量分数为
| 0.416g |
| 0.462g |
故答案为:90.04%;
点评:本题以工艺流程为基础,考察化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
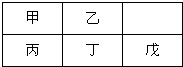 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |
常温下,下列各组离子一定能大量共存的是( )
| A、滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | ||
B、
| ||
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
下列反应的离子方程式书写正确的是( )
| A、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
| B、钠和水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O |
| D、盐酸中加入氢氧化镁:H++OH-=H2O |
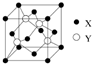 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态. 地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.
地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.