题目内容
6.已知X、Y为有刺激性气味的气体,有如图转化关系,部分产物未标出.试回答:
(1)写出下列物质的化学式:XCl2YSO2AHClBH2SO4CFeCl3.
(2)反应①的化学方程式为Cl2+SO2+2H2O═2HCl+H2SO4,反应②的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(3)将气体Y通入下列溶液中,溶液会褪色的是ACD;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(4)为防止X气体污染空气,可用NaOH溶液吸收,原理是(用离子方程式表示)Cl2+2OH-=ClO-+Cl-+H2O.
分析 A与硝酸银溶液、稀硝酸生成白色沉淀,可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀,可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体,可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4.
解答 解:A与硝酸银溶液、稀硝酸生成白色沉淀,可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀,可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体,可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4.
(1)由以上分析可知X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3,
故答案为:Cl2;SO2;HCl;H2SO4;FeCl3;
(2)反应①的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,反应②的离子方程式为反应的离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(3)Y为SO2,具有漂白性,可以使品红溶液褪色,溶液是呈酸性,使紫色石蕊试液变红色,具有还原性,可以被酸性高锰酸钾溶液、溴水氧化,使它们溶液颜色褪去,
故选:ACD;
(4)为防止X(氯气)气体污染空气,可用NaOH溶液吸收,原理是(用离子方程式表示):Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O.
点评 本题考查无机物的推断,A、B分别为硝酸银、氯化钡反应现象为推断突破口,侧重于学生的分析能力和元素化合物知识的综合运用的考查,难度中等.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | N2→NO→NO2 | B. | Fe→FeCl2→Fe (OH)2 | C. | S→SO3→H2SO4 | D. | Na→Na2O2→NaOH |
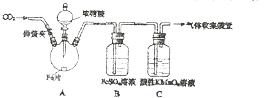 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | / |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余 |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
①新制氯水久置后→浅黄绿色消失 ②Cl2通入石蕊试液中→先变红后褪色 ③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去 ⑤氨气通入酚酞溶液中→红色 ⑥N2和O2放电条件下→直接生成红棕色气体.
| A. | ①②③⑥ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
| A | |||||||
| B | C | D | |||||
| E | F | G | H | I | |||
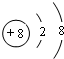 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为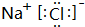 .
.(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
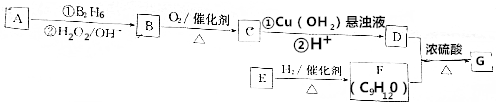
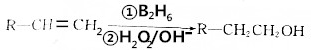
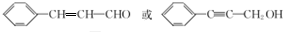 .
.