题目内容
16.已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C(1)D是具有氧化性的气体单质
①若A是一种活泼金属单质,则化合物C的用途之一为呼吸面具或潜水艇中的供氧剂.
②若A是一种固态非金属单质,化合物B、C的相对分子质量之比为7:11,则实验室制取C的反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O.
③若A是能使湿润的红色石蕊试纸变蓝的气体,则A转化为B反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)D是一种常见金属单质
①若A 是一种黄绿色气体,贮存溶液C时应加入少量D,其理由是2Fe3++Fe=3Fe2+(用离子方程式说明).
②若A是一种强氧化性酸,则B的化学式为Fe(NO3)3或Fe3(SO4)3.
(3)若D是一种常见的温室气体,A是一种强碱.则B转化为C的离子方程式为CO32-+CO2+H2O=2HCO3-.
(4)若B是一种两性氢氧化物,且无论D是强酸还是强碱,上述转化关系都成立.则用B中所含金属元素的单质、强酸及强碱来制取1mol B时,所需强酸及强碱的物质的量之和以[n(H+)+n(OH-)计]的最小值为1.5mol.
分析 根据题中各物质的转化关系,
(1)D是具有氧化性的气体单质,①若A是一种活泼金属单质,则A为Na,B为Na2O,D为O2,C为Na2O2;
②若A是一种固态非金属单质,化合物B、C的相对分子质量之比为7:11,则A为C,B为CO,D为O2,C为CO2;
③若A是能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,B为NO,C为NO2,D为O2;
(2)D是一种常见金属单质,则D应有可变价,
①若A 是一种黄绿色气体,则A为Cl2,D为Fe,B为FeCl3,C为FeCl2;
②若A是一种强氧化性酸,则A为HNO3 或H2SO4,B为Fe(NO3)3 或Fe3(SO4)3,D为Fe,C为Fe(NO3)2 或FeSO4;
(3)若D是一种常见的温室气体,A是一种强碱,则A为NaOH,D为CO2,B为Na2CO3,C为NaHCO3;
(4)若B是一种两性氢氧化物,且无论D是强酸还是强碱,上述转化关系都成立,则A为AlCl3或NaAlO2,B为Al(OH)3,C为NaAlO2或AlCl3.
解答 解:根据题中各物质的转化关系,
(1)D是具有氧化性的气体单质,①若A是一种活泼金属单质,则A为Na,B为Na2O,D为O2,C为Na2O2,化合物C的用途之一为呼吸面具或潜水艇中的供氧剂,
故答案为:呼吸面具或潜水艇中的供氧剂;
②若A是一种固态非金属单质,化合物B、C的相对分子质量之比为7:11,则A为C,B为CO,D为O2,C为CO2,实验室用碳酸钙与稀盐酸反应制取C,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
③若A是能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,B为NO,C为NO2,D为O2,则A转化为B反应的化学方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)D是一种常见金属单质,则D应有可变价,
①若A 是一种黄绿色气体,则A为Cl2,D为Fe,B为FeCl3,C为FeCl2,贮存FeCl2溶液时应加入少量Fe,其理由是防止亚铁离子被氧化,反应离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
②若A是一种强氧化性酸,则A为HNO3 或H2SO4,B为Fe(NO3)3 或Fe3(SO4)3,D为Fe,C为Fe(NO3)2 或FeSO4,
故答案为:Fe(NO3)3 或Fe3(SO4)3;
(3)若D是一种常见的温室气体,A是一种强碱,则A为NaOH,D为CO2,B为Na2CO3,C为NaHCO3,则B转化为C的离子方程式为CO32-+CO2+H2O=2HCO3-,
故答案为:CO32-+CO2+H2O=2HCO3-;
(4)若B是一种两性氢氧化物,且无论D是强酸还是强碱,上述转化关系都成立,则A为AlCl3或NaAlO2,B为Al(OH)3,C为NaAlO2或AlCl3,用Al与强酸及强碱来制取1molAl(OH)3时,要使所需强酸及强碱的物质的量之和最小,可用0.25molAl的,与H+反应,需要H+0.75mol,用0.75mol Al的与OH-反应,需要OH-0.75mol,再用0.75mol AlO2-与0.25molAl3+发生双水解可得1mol,所以[n(H+)+n(OH-)计]的最小值为0.75mol+0.75mol=1.5mol,
故答案为:1.5.
点评 本题考查无机物推断,物质的颜色等是推断突破口,注意掌握中学常见A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C型转化关系,需要学生熟练掌握元素化合物知识,难度中等.

Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是0.053.
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412.5 | 348 | 612 | 436 |
计算上述反应的△H=125 kJ•mol-1.若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.此时,该反应是否达到了平衡状态?是(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.

(4)由图Ⅰ可知,T1大于T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将越大(填“越大”、“越小”或“不变”),原因是水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
| A. | 含1molNa2S的溶液,最多可吸收2molSO2 | |
| B. | 可以用浓硫酸除去镀在铝表面的铜镀层 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| A. | 温度 | B. | 浓度 | C. | 催化剂 | D. | 反应物的性质 |
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 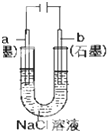 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 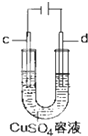 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )| A. | 在t5时,容器NO2的体积分数是整个过程中的最大值 | |
| B. | 在t2时,采取的措施可以是增大压强 | |
| C. | 在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 | |
| D. | 在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 |
 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液(pH=4)进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
 .
. .
. ,
, 、
、 .(写两种即可)
.(写两种即可)