题目内容
17.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )| A. | 铍的原子失电子能力比镁弱 | |
| B. | Tl(OH)3 和Al(OH)3一样都属于两性氢氧化物 | |
| C. | 硫化氢比硒化氢稳定 | |
| D. | 锂与氧气在点燃的条件下生成氧化锂 |
分析 A.同主族,从上到下金属性增强;
B.同主族,从上到下金属性增强,对应最高价氧化物水化物的碱性增强;
C.同主族,从上到下非金属性减弱,对应氢化物稳定性减弱;
D.Li的金属性较弱,燃烧只生成一种氧化物.
解答 解:A.同主族,从上到下金属性增强,则铍的原子失电子能力比镁弱,故A正确;
B.同主族,从上到下金属性增强,对应最高价氧化物水化物的碱性增强,则Tl(OH)3为强碱,故B错误;
C.同主族,从上到下非金属性减弱,对应氢化物稳定性减弱,则硫化氢比硒化氢稳定,故C正确;
D.Li的金属性较弱,燃烧只生成一种氧化物,则锂与氧气在点燃的条件下生成氧化锂,故D正确;
故选B.
点评 本题考查周期表与元素周期律,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.某元素的原子序数是34,则该基态原子中电子占据的原子轨道总数为( )
| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
5.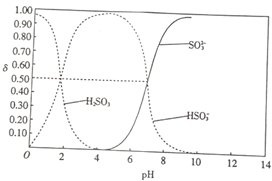 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
12.具有下列电子层结构的原子或离子,其对应的元素一定属于同一周期的是( )
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
2.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C2H6O溶于水后均不导电 | P4O10、C2H6O均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
9.1869年,俄国化学家门捷列夫制作了第一张元素周期表,成为化学史上重要的里程碑之一,下列有关元素周期表的说法正确的是( )
| A. | 在元素周期表中,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有18个族 | |
| C. | ⅠA族的元素不全都是金属元素 | |
| D. | 短周期指的是一、二、三、四周期 |
7.某有机物的结构简式为: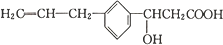 其可发生反应的类型有( )
其可发生反应的类型有( )
①取代反应 ②加成反应 ③水解反应 ④酯化反应 ⑤消去反应 ⑥加聚反应
⑦氧化反应 ⑧中和反应.
 其可发生反应的类型有( )
其可发生反应的类型有( )①取代反应 ②加成反应 ③水解反应 ④酯化反应 ⑤消去反应 ⑥加聚反应
⑦氧化反应 ⑧中和反应.
| A. | ①②④⑤⑥⑦⑧ | B. | ①②③④⑤⑥⑦ | C. | ②③④⑤⑥⑦⑧ | D. | ①②③④⑥⑦⑧ |