题目内容
如图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
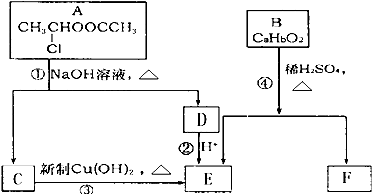
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是 、 (写化学式);D装置的作用是 .
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有 、
.(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3.能产生大量NH3的原因是:
a ; b ; c .
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是: → → → (填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是 (用字母表示);用化学方程式解释红棕色气体产生的原因: 、 .

(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3.能产生大量NH3的原因是:
a
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)①装置A中产生的氢气被浓硫酸干燥后通过盛有灼热的氧化铜装置B,由于氢气具有还原性能将氧化铜还原为铜,通过盛有无水硫酸铜的装置B验证水的生成,最后连接装置D是为了防止空气中的水蒸气进入盛有无水硫酸铜的装置B中,影响氢气的氧化产物水的检验;
②题意是可知氢气的反应速率,根据影响反应速率的因素进行解答,如降低氢离子浓度、降低温度等;
(2)①过氧化钠能和水反应生成氢氧化钠和氧气,且该反应是放热反应;浓氨水有挥发性,温度越高挥发性越强,且氨水中存在电离平衡,氢氧根离子浓度增大,电离程度减小;过氧化钠反应消耗水,溶剂减少溶解的氨气减小;
②用产生的气体做氨的催化氧化实验,需要的装置有产生氨气、氧气的装置、干燥装置、反应装置、尾气处理装置,据此进行连接装置;
装置B中氨气与氧气发生反应生成一氧化氮气体,一氧化氮与氧气反应生成红褐色的二氧化氮,据此写出反应的化学方程式.
②题意是可知氢气的反应速率,根据影响反应速率的因素进行解答,如降低氢离子浓度、降低温度等;
(2)①过氧化钠能和水反应生成氢氧化钠和氧气,且该反应是放热反应;浓氨水有挥发性,温度越高挥发性越强,且氨水中存在电离平衡,氢氧根离子浓度增大,电离程度减小;过氧化钠反应消耗水,溶剂减少溶解的氨气减小;
②用产生的气体做氨的催化氧化实验,需要的装置有产生氨气、氧气的装置、干燥装置、反应装置、尾气处理装置,据此进行连接装置;
装置B中氨气与氧气发生反应生成一氧化氮气体,一氧化氮与氧气反应生成红褐色的二氧化氮,据此写出反应的化学方程式.
解答:
解:(1)①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末,装置A中产生的氢气被浓硫酸干燥后通过灼热的氧化铜,由于氢气具有还原性能将氧化铜还原为铜,通过无水硫酸铜验证水的生成;
D装置装有碱石灰,碱石灰的成分为氧化钙和氢氧化钠,能吸收水和二氧化碳,该实验的目的为验证氢气的还原性并检验其氧化产物水,防止空气中的水进入装置,干扰水的检验,需用装置D,
故答案为:CuO;CuSO4; 防止空气中的水进入装置,干扰H2氧化产物的检验;
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可以通过控制分液漏斗的活塞,使稀H2SO4缓慢滴下,从而使产生氢气的反应速率减小;也可以在烧瓶中进入少量水或将烧瓶放入冰水中或用冰毛巾捂着烧瓶或加入醋酸钠固体,都能够降低产生氢气的反应速率,
故答案为:控制分液漏斗的活塞,使稀H2SO4缓慢滴下;加水(或将烧瓶放入冰水中或用冰毛巾捂着烧瓶或加入醋酸钠固体等);
(2)①过氧化钠能和水反应生成氢氧化钠和氧气,该反应为放热反应,降低了氨气的溶解度,有利于氨气的生成;过氧化钠与水反应中消耗了水,水减少则溶解的氨气减少;反应后的溶液中氢氧根离子浓度增大,抑制了氨水的电离,有利于氨气的生成,
故答案为:Na2O2与水反应放热,降低NH3的溶解度(或使NH3?H2O发生分解);Na2O2与水反应,耗水(或使水量减少),降低NH3的溶解量; Na2O2与水反应生成OH-,c(OH-)增大,抑制NH3?H2O的电离有利于NH3的逸出;
②用产生的气体做氨的催化氧化实验,产生的氨气的装置为A,氨气中含有水蒸气,所以需要干燥装置D;氨气和氧气的反应需要反应装置B;反应后的气体不能直接排空,需要尾气处理装置,以含有氮的氧化物,则用碱液来处理尾气装置E,所以装置连接顺序为:A→D→B→E;
装置B中氨气与氧气在催化剂作用下加热反应生成一氧化氮和水,一氧化氮与氧气反应生成红棕色的二氧化氮,所以出现红棕色的装置为B,反应的化学方程式为:4NH3+5O2
4NO+6H2O、2NO+O2═2NO2,
故答案为:A→D→B→E(或D);B;4NH3+5O2
4NO+6H2O;2NO+O2═2NO2.
D装置装有碱石灰,碱石灰的成分为氧化钙和氢氧化钠,能吸收水和二氧化碳,该实验的目的为验证氢气的还原性并检验其氧化产物水,防止空气中的水进入装置,干扰水的检验,需用装置D,
故答案为:CuO;CuSO4; 防止空气中的水进入装置,干扰H2氧化产物的检验;
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可以通过控制分液漏斗的活塞,使稀H2SO4缓慢滴下,从而使产生氢气的反应速率减小;也可以在烧瓶中进入少量水或将烧瓶放入冰水中或用冰毛巾捂着烧瓶或加入醋酸钠固体,都能够降低产生氢气的反应速率,
故答案为:控制分液漏斗的活塞,使稀H2SO4缓慢滴下;加水(或将烧瓶放入冰水中或用冰毛巾捂着烧瓶或加入醋酸钠固体等);
(2)①过氧化钠能和水反应生成氢氧化钠和氧气,该反应为放热反应,降低了氨气的溶解度,有利于氨气的生成;过氧化钠与水反应中消耗了水,水减少则溶解的氨气减少;反应后的溶液中氢氧根离子浓度增大,抑制了氨水的电离,有利于氨气的生成,
故答案为:Na2O2与水反应放热,降低NH3的溶解度(或使NH3?H2O发生分解);Na2O2与水反应,耗水(或使水量减少),降低NH3的溶解量; Na2O2与水反应生成OH-,c(OH-)增大,抑制NH3?H2O的电离有利于NH3的逸出;
②用产生的气体做氨的催化氧化实验,产生的氨气的装置为A,氨气中含有水蒸气,所以需要干燥装置D;氨气和氧气的反应需要反应装置B;反应后的气体不能直接排空,需要尾气处理装置,以含有氮的氧化物,则用碱液来处理尾气装置E,所以装置连接顺序为:A→D→B→E;
装置B中氨气与氧气在催化剂作用下加热反应生成一氧化氮和水,一氧化氮与氧气反应生成红棕色的二氧化氮,所以出现红棕色的装置为B,反应的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:A→D→B→E(或D);B;4NH3+5O2
| ||
| △ |
点评:本题考查了物质性质实验方案的设计与评价,涉及了过氧化钠的性质、合成氨的反应原理、氢气的实验室制法等知识,题目难度中等,正确理解反应原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力,是一道质量不错的题目.

练习册系列答案
相关题目
能正确表示下列化学反应的离子方程式是( )
| A、氢氧化钡溶液与稀硫酸的反应OH-+H+=H2O |
| B、氧化镁与稀盐酸反应MgO+2H+=Mg2++H2O |
| C、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D、少量碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2CO3 |
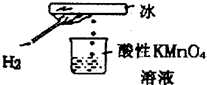 某化学研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.判断下列说法中正确的是( )
某化学研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.判断下列说法中正确的是( )| A、该条件下生成的水分子化学性质比较活泼 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有还原性 |
| C、该条件下H2燃烧生成了具有还原性的物质 |
| D、该条件下H2燃烧的产物中可能含有一定量的H2O2 |
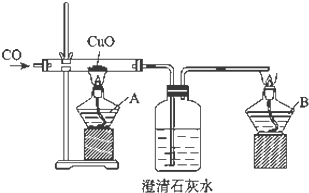 证明CO具有还原性的实验装置,如图所示.
证明CO具有还原性的实验装置,如图所示. 请根据图作答:
请根据图作答: