题目内容
一定温度下,某容积不变的密闭容器中,不能说明可逆反应:C(s)+H2O(g)?CO(g)+H2(g)在一定条件下已达到化学平衡状态的是( )
| A、v正(CO)=v逆(H2O) |
| B、体系的压强不再发生变化 |
| C、生成n mol CO的同时生成n mol H2 |
| D、1 mol H-H键断裂的同时断裂2 mol H-O键 |
考点:化学平衡状态的判断
专题:
分析:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断.
解答:
解:A、根据反应可知,自始至终v正(CO)=v正(H2O),若v正(CO)=v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,故A不符合;
B、反应前后气体的物质的量发生变化,容器中始终压强不变,能说明反应到达平衡,故B不符合;
C.根据反应可知,生成n mol CO的同时生成n mol H2,反应正向进行,不能说明反应到达平衡,故C符合;
d.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故D不符合;
故选C.
B、反应前后气体的物质的量发生变化,容器中始终压强不变,能说明反应到达平衡,故B不符合;
C.根据反应可知,生成n mol CO的同时生成n mol H2,反应正向进行,不能说明反应到达平衡,故C符合;
d.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故D不符合;
故选C.
点评:本题考查化学平衡状态的判断,掌握实质是解题关键,题目难度中等.

练习册系列答案
相关题目
本地的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中( )
| A、石蕊溶液 |
| B、四氯化碳 |
| C、氢氧化钠溶液 |
| D、硝酸酸化的硝酸银溶液 |
下列试剂的保存方法不正确的是 ( )
| A、白磷保存在水中 |
| B、金属钠保存在煤油中 |
| C、浓硝酸保存在棕色试剂瓶中 |
| D、氢氧化钠溶液保存在带磨口玻璃塞的玻璃瓶中 |
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述中正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
| A、阳极发生还原反应,其电极反应式:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C、电解后,溶液中存在的离子只有Fe2+ 和Zn2+ |
| D、电解后,Cu和Pt沉降在电解槽底部形成阳极泥 |
下列关于铷的叙述不正确的是( )
| A、金属铷投入水中会引起爆炸 |
| B、铷是一种强还原剂,铷离子很稳定 |
| C、铷受热后,能在空气中剧烈燃烧,生成比过氧化物更复杂的氧化物 |
| D、铷原子的核电荷数比钾原子的核电荷数多,因此铷原子失电子的能力小于钾原子 |
元素周期表中ⅣA元素包括C、Si、Ce、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定.结合所学知识,判断下列反应中(反应条件略)正确的是( )
①Pb+2Cl2=PbCl4
②Sn+2Cl2=SnCl4
③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O.
①Pb+2Cl2=PbCl4
②Sn+2Cl2=SnCl4
③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O.
| A、①②④⑤ | B、①②③④ |
| C、①②③ | D、②③⑤ |
下列有关说法不正确的是( )
| A、C3H8中碳原子都采用的是sp3杂化 |
| B、O2、CO2、N2都是非极性分子 |
| C、酸性:H2CO3<H3PO4<H2SO4<HClO |
D、CO的一种等电子体为NO+,它的电子式为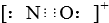 |