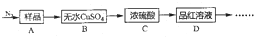
题目内容
4.化合物A的结构简式为CH2=C(CH3)-CH=CH2,A的系列反应如下(部分条件略去)
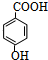
已知:

回答下列问题:
(1)A的化学名称是2-甲基-1,3-丁二烯;
(2)B的分子式为C5H8O2;
(3)反应②的反应方程式
 ;
;(4)①和②的反应类型分别是加成反应,加成反应.
分析 (1)选取含有碳碳双键的碳原子最多的链为主链,选取离碳碳双键最近的碳原子为1号碳原子给A命名;
(2)结合题给信息知,该反应发生题给信息的反应,A的结构简式为CH2=C(CH3)-CH=CH2,则B结构简式为CH2=CHCOOCH2CH3,根据结构简式确定分子式;
(3)反应②为加成反应,根据反应物和生成物写方程式;
(4)根据反应特点知,①和②的反应类型都是加成反应.
解答 解:(1)选取含有碳碳双键的碳原子最多的链为主链,选取离碳碳双键最近的碳原子为1号碳原子给A命名,则A的名称是2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(2)结合题给信息知,该反应发生题给信息的反应,A的结构简式为CH2=C(CH3)-CH=CH2,则B结构简式为
CH2=CHCOOCH2CH3,根据结构简式确定分子式为C5H8O2,故答案为:C5H8O2;
(3)反应②为加成反应,根据反应物和生成物写方程式为 ,故答案为:
,故答案为: ;
;
(4)根据反应特点知,①和②的反应类型都是加成反应,故答案为:加成反应;加成反应.
点评 本题考查有机物结构和性质,为高频考点,根据反应前后某些物质分子式及结构简式变化结合题给信息确定反应类型,侧重考查学生分析判断及知识迁移能力,题目难度不大.

练习册系列答案
相关题目
14.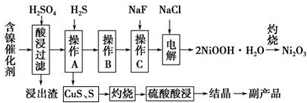 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
已知常温下:①有关氢氧化物开始沉淀和沉淀完全
的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
15.X、Y、Z、W是原子序数依次增大的短周期元素,X的一种原子没有中子,Y、Z易形成质量比为3:4和3:8的两种常见化合物,W所在的周期数和族序数相同.下列说法正确的是( )
| A. | W的最高价氧化物对应水化物是强碱 | |
| B. | 原子半径:Y<Z<W | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 原子最外层电子数:W>Z>Y |
19.下列水解化学方程式或水解离子方程式正确的是( )
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | Al3++H2O?Al(OH)3+H+ | ||
| C. | CH3COOH+NaOH?CH3COONa+H2O | D. | NaCl+H2O?NaOH+HCl |
9.已知醋酸与氢氧化钠在溶液中发生下列反应①,醋酸钠在溶液中又能跟水发生下列反应②.
①CH3COOH+Na0H=CH3COONa+H20
②CH3COONa+H20?CH3COOH+Na0H
上述化学方程式①和②可合并写为
③CH3COOH+Na0H=CH3COONa+H20
下列叙述正确的是( )
①CH3COOH+Na0H=CH3COONa+H20
②CH3COONa+H20?CH3COOH+Na0H
上述化学方程式①和②可合并写为
③CH3COOH+Na0H=CH3COONa+H20
下列叙述正确的是( )
| A. | 反应①和②都是离子反应 | B. | 反应①和②都吸收热量 | ||
| C. | 反应①和②都放出热量 | D. | 反应③既不吸收热量也不放出热量 |
16.400K,101.3kPa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下).若a=8L时,该烃可能的分子式是( )
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C3H8 |
6.下列关于阿伏加德罗常数NA的说法正确的是( )
| A. | 8g CH4所含共价键数目为2NA | |
| B. | 0.5NA 个氯气分子与水反应转移电子数为0.5NA | |
| C. | 50mL12mol/L盐酸与足量的MnO2共热,转移的电子数为0.3NA | |
| D. | 1 L0.2mol/L的Na2S溶液中离子数为0.6NA |
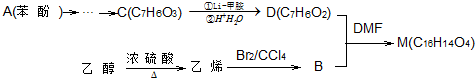

 .
.