题目内容
15.燃料电池是一种利用能源物质的新的形式,比如我们可用熔融的K2CO3作电解质,惰性材料作电极,一极通CH2=CH2,另一极通O2、CO2下列说法中不正确的是( )| A. | 正极发生的电极反应为:3O2+6CO2+12e-═6CO${\;}_{3}^{2-}$ | |
| B. | 通入乙烯的一极为正极 | |
| C. | 负极发生的电极反应为:CH2=CH2+6CO${\;}_{3}^{2-}$-12e-═8CO2+2H2O | |
| D. | 电池的总反应式为:CH2=CH2+3O2═2CO2+2H2O |
分析 碱性乙烯燃料电池,具有还原性的乙烯为原电池的负极,发生氧化反应,电极反应式为CH2=CH2+6CO32--12e-═8CO2+2H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为3O2+6CO2+12e-═6CO32-,据此结合选项分析解答.
解答 解:A.燃料电池的正极上是氧气发生得电子的还原反应,即3O2+6CO2+12e-═6CO32-,故A正确;
B.燃料电池中,通入燃料乙烯的电极是负极,故B错误;
C.燃料电池的负极上燃料发生失去电子的氧化反应,即CH2=CH2+6CO32-═8CO2+2H2O+12e-,故C正确;
D.乙烯燃料电池的总反应是燃料乙烯燃烧的方程式,即CH2=CH2+3O2=2CO2+2H2O,故D正确.
故选B.
点评 本题考查了原电池中燃料电池的工作原理,为高频考点,侧重于学生的分析能力的考查,明确正负极上得失电子的物质以及电极式的书写是解本题关键,难度不大.

练习册系列答案
相关题目
3.现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复).
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性.
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失.
③M溶液与另外四种溶液反应都能产生沉淀.
下列说法正确的是( )
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失.
③M溶液与另外四种溶液反应都能产生沉淀.
下列说法正确的是( )
| A. | N溶液与过量的F溶液反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E溶液与N溶液混合发生反应的离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| C. | M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中 | |
| D. | 将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-═CO2↑+H2O |
10.在水溶液中橙色的Cr2O72-与黄色的CrO42-存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,已知重铬酸钾(K2Cr2O7)稀溶液为橙色.取甲、乙两支试管分别加入2mL重铬酸钾稀溶液,进行如下操作:
(1)向甲试管中加入NaOH溶液,上述平衡向方向正反应移动(填“正反应”或“逆反应”);
(2)向乙试管中加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),溶液最终显无色.
(1)向甲试管中加入NaOH溶液,上述平衡向方向正反应移动(填“正反应”或“逆反应”);
(2)向乙试管中加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),溶液最终显无色.
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
20.一定条件下,向一带活塞的密闭容器中充入1mol N2和3mol H2,发生下列反应:N2(g)+3H2(g)═2NH3(g),反应达到平衡后,改变下述条件,NH3 气体平衡浓度不改变的是( )
| A. | 保持温度和容器压强不变,充入1 mol NH3(g) | |
| B. | 保持温度和容器体积不变,充入1 mol NH3(g) | |
| C. | 保持温度和容器压强不变,充入1 mol N2(g) | |
| D. | 保持温度和容器体积不变,充入1 mol Ar(g) |
7.下列各表述与示意图一致的是( )
| A. | 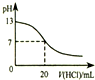 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 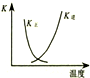 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 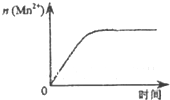 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 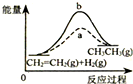 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
2.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
 基本不变”)。
基本不变”)。
 ,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。 2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:其中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:其中正确的是