题目内容
9.标准状况下,将20LCO2和CO的混合气全通过足量的Na2O2粉末,在相同状况下,气体体积减少到16L,则原混合气体中CO的体积为( )| A. | 4L | B. | 8L | C. | 12L | D. | 16L |
分析 混合气体中只有CO2和Na2O2反应,反应方程式为2CO2+2Na2O2=2Na2CO3+O2,利用差量法计算二氧化碳体积,然后计算CO体积.
解答 解:混合气体中只有CO2和Na2O2反应,反应方程式为2CO2+2Na2O2=2Na2CO3+O2,设二氧化碳体积为x,
2CO2+2Na2O2=2Na2CO3+O2 体积减少
44.8L 22.4L
x (20-16)L
44.8L:22.4L=x:(20-16)L
解得 x=8L
则V(CO)=(20-8)L=12L,
故选C.
点评 本题考查混合物的有关计算,明确反应中气体体积变化是解本题关键,侧重考查学生分析计算能力,注意差量法的灵活运用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某有机原料的结构简式如图,下列有关该有机物的叙述正确的是( )
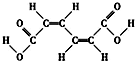

| A. | 该物质有三种3种不同化学环境的氢(不考虑顺反异构) | |
| B. | 1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3 | |
| C. | 该有机物能发生加成反应不能发生取代反应 | |
| D. | 该有机物与乙酸互为同系物 |
17.硫酸钠和氯化钠溶液等体积混合后,钠离子浓度为0.7mol•L-1,硫酸根离子的浓度为0.2mol•L-1,则混合液中氯离子的浓度为( )
| A. | 0.15mol•L-1 | B. | 0.3mol•L-1 | C. | 0.45mol•L-1 | D. | 0.2mol•L-1 |
4.下列离子方程式书写正确的是( )
| A. | Na投入到足量的盐酸中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2 | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
14.下列说法正确的是( )
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
1.下列说法中,正确的是( )
| A. | 有机物都能燃烧生成二氧化碳和水,且受热不易分解 | |
| B. | 有机物大多数难溶于水而易溶于汽、四氯化碳等有机溶剂 | |
| C. | 有机物都是非电解质且熔点、沸点较低 | |
| D. | 有机化学反应都较复杂,且副反应多,反应速率慢 |
18.在某恒温恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H=-Q kJ/mol(Q>0),保持其它条件不变,只改变起始添加量,测得相关数据如表所示
下列说法中错误的是( )
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(kJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α3 | φ3 | Q3 |
| A. | α1+α2=1; φ2=φ1 | B. | α1=α3;Q1+Q2=Q | ||
| C. | φ3=φ1=φ2; Q3=2Q1 | D. | φ3=2φ1; Q3=Q1 |
19.只给出表中甲和乙对应的量,不能用来求物质的量的是( )
| 甲 | 乙 | |
| A | 物质A的分子数 | 一个A分子的质量 |
| B | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
| C | 固体体积 | 固体密度 |
| D | 非标准状况下物质的质量 | 物质的摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |