题目内容
Na+、Cu2+、Ba2+等阳离子与Br-、HCO3-、CO32-、OH-两两形成若干化合物.根据下列性质写出A、B、C、D、E化合物的化学式:
(1)A的溶液显蓝色,不与盐酸反应.
(2)B和A的溶液混合生成蓝色沉淀,B中加H2SO4无沉淀、无气体产生.
(3)C的溶液通入Cl2后,溶液为橙色,加H2SO4生成白色沉淀,但无气体放出.
(4)D与C混合产生白色沉淀.
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀.
则A ,B ,C ,D ,E (都填化学式)
写出离子方程式:C+Cl2 ;E+C+B: .
(1)A的溶液显蓝色,不与盐酸反应.
(2)B和A的溶液混合生成蓝色沉淀,B中加H2SO4无沉淀、无气体产生.
(3)C的溶液通入Cl2后,溶液为橙色,加H2SO4生成白色沉淀,但无气体放出.
(4)D与C混合产生白色沉淀.
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀.
则A
写出离子方程式:C+Cl2
考点:常见离子的检验方法,离子方程式的书写
专题:离子反应专题
分析:(1)A的溶液显蓝色,不与盐酸反应,A溶液中含有铜离子、溴离子,A为CuBr2;
(2)B和A的溶液混合生成蓝色沉淀,蓝色沉淀为氢氧化铜,B中加H2SO4无沉淀、无气体产生,B中不含有钡离子、HCO3-、CO32-,则B只能为NaOH;
(3)C的溶液通入Cl2后,溶液为橙色,则C中含有溴离子;加H2SO4生成白色沉淀,但无气体放出,则C中含有钡离子,则C为BaBr2;
(4)D与C混合产生白色沉淀,则D中含有CO32-,根据离子共存可知,D只能为Na2CO3;
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀,则E中含有HCO3-,则E为NaHCO3〔或Ba(HCO3)2〕,
根据以上分析进行解答即可.
(2)B和A的溶液混合生成蓝色沉淀,蓝色沉淀为氢氧化铜,B中加H2SO4无沉淀、无气体产生,B中不含有钡离子、HCO3-、CO32-,则B只能为NaOH;
(3)C的溶液通入Cl2后,溶液为橙色,则C中含有溴离子;加H2SO4生成白色沉淀,但无气体放出,则C中含有钡离子,则C为BaBr2;
(4)D与C混合产生白色沉淀,则D中含有CO32-,根据离子共存可知,D只能为Na2CO3;
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀,则E中含有HCO3-,则E为NaHCO3〔或Ba(HCO3)2〕,
根据以上分析进行解答即可.
解答:
解:(1)题中离子只有铜离子为蓝色,则A溶液中含有铜离子,阴离子中只有溴离子与铜离子形成可溶性物质,所以A为CuBr2;
(2)生成的蓝色沉淀为氢氧化铜,B中加H2SO4无沉淀、无气体产生可知:B中不含有Ba2+、HCO3-、CO32-,则B只能为NaOH;
(3)通入Cl2后溶液为橙色,则C中含有Br-;加H2SO4生成白色沉淀,但无气体放出,则C中含有Ba2+,故C为BaBr2;
(4)D与C混合产生白色沉淀,则D中含有CO32-,阳离子中只有钠离子与碳酸根离子形成可溶性物质,则D只能为Na2CO3;
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀,则E中含有HCO3-,则E为NaHCO3〔或Ba(HCO3)2〕,
根据以上分析可知:A:CuBr2 B:NaOH C:BaBr2 D:Na2CO3E:NaHCO3〔或Ba(HCO3)2〕,
C为溴化钡,溴化钡与氯气反应的离子方程式为:2Br-+Cl2=Br2+2Cl-;
E中含有碳酸氢根离子、C中含有钡离子、B为氢氧化钠,E和B、C反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:CuBr2;NaOH;BaBr2;Na2CO3;NaHCO3〔或Ba(HCO3)2〕;2Br-+Cl2=Br2+2Cl-;HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)生成的蓝色沉淀为氢氧化铜,B中加H2SO4无沉淀、无气体产生可知:B中不含有Ba2+、HCO3-、CO32-,则B只能为NaOH;
(3)通入Cl2后溶液为橙色,则C中含有Br-;加H2SO4生成白色沉淀,但无气体放出,则C中含有Ba2+,故C为BaBr2;
(4)D与C混合产生白色沉淀,则D中含有CO32-,阳离子中只有钠离子与碳酸根离子形成可溶性物质,则D只能为Na2CO3;
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀,则E中含有HCO3-,则E为NaHCO3〔或Ba(HCO3)2〕,
根据以上分析可知:A:CuBr2 B:NaOH C:BaBr2 D:Na2CO3E:NaHCO3〔或Ba(HCO3)2〕,
C为溴化钡,溴化钡与氯气反应的离子方程式为:2Br-+Cl2=Br2+2Cl-;
E中含有碳酸氢根离子、C中含有钡离子、B为氢氧化钠,E和B、C反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:CuBr2;NaOH;BaBr2;Na2CO3;NaHCO3〔或Ba(HCO3)2〕;2Br-+Cl2=Br2+2Cl-;HCO3-+Ba2++OH-=BaCO3↓+H2O.
点评:本题考查了常见离子的检验、离子方程式的书写,题目难度中等,注意掌握常见离子的检验方法、明确离子方程式的书写要求,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
下列溶液中一定可以大量共存的离子组是( )
| A、pH为2的溶液中:K+、Mg2+、I-、ClO- |
| B、Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- |
| C、(NH4)2Fe(SO4)2?6H2O溶液中:Na+、Cu2+、Cl-、H+ |
| D、NaH2PO4的溶液中:NH4+、K+、HS-、CO32- |
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是( )
| A、使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+ |
| B、使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| C、由水电离出的c(H+)=1×10-12mol?L-1的溶液中:K+、Cl-、NO3-、Na+ |
| D、在0.1mol/L的氯化铁溶液中:Ⅰ-、NH4+、NO3-、Cl- |
下列4种装置工作一段时间后,测得导线上均通过了0.002mol 电子,此时溶液的pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)( )
①盛100mL CuSO4 ②盛200mL 0.01mol?L-1 H2SO4 ③盛200mL ZnCl2 ④盛200mL NaCl饱和溶液
①盛100mL CuSO4 ②盛200mL 0.01mol?L-1 H2SO4 ③盛200mL ZnCl2 ④盛200mL NaCl饱和溶液

| A、④②③① | B、④③②① |
| C、④③①② | D、④①③② |
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含0.1 mol BaCl2的溶液中Cl-数为0.1 NA |
| B、22 g CO2所含有的分子数为0.5 NA |
| C、11.2L CO2所含有的分子数为0.5 NA |
| D、常温下NA 个Cl2分子所占有的体积为22.4L |


 ,关于它的下列说法正确的是
,关于它的下列说法正确的是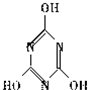 ).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是
).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是