题目内容
19.实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:(1)配制250mL0.1mol/L的盐酸溶液.应量取盐酸体积2.1mL,所需要的仪器有量筒、胶头滴管、烧杯、玻璃杯、250mL容量瓶.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)容量瓶是配制溶液的必需仪器.下列关于容量瓶及其使用方法的叙述,错误的是c.
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶长期贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液
⑥容量瓶上标有的是温度、容量、刻度线
a.①③b.①④c.③⑤d.⑤⑥
分析 (1)依据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸的体积,依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,据此排序;
(3)容量瓶上标有的是温度、容量、刻度线,用来配制一定物质的量浓度的溶液专用仪器,使用前要先检查容量瓶是否漏液,不能用来加热,不能用容量瓶贮存配制好的溶液,500mL容量瓶不能用来配制250mL溶液,只能配置500mL溶液;
解答 解:(1)密度为1.18g/mL,质量分数为36.5%浓盐酸物质的量浓度C=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:11.8mol/L×V=250mL×0.1mol/L,解得V=2.1mL;配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,用到的仪器:量筒、胶头滴管、烧杯、玻璃杯、容量瓶,配制250mL溶液应选择250mL容量瓶,所以需要的仪器:量筒、胶头滴管、烧杯、玻璃杯、250mL容量瓶;
故答案为:2.1;量筒、胶头滴管、烧杯、玻璃杯、250mL容量瓶;
(2)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,所以正确的操作顺序为:BCAFED;
故答案为:BCAFED;
(3)①容量瓶是配制一定物质的量浓度的溶液的专用仪器,故①正确;
②容量瓶使用前要先检查容量瓶是否漏液,故②正确;
③容量瓶不能用来加热,故③错误;
④容量瓶为精密仪器不能用容量瓶贮存配制好的溶液,故④正确;
⑤500mL容量瓶不能用来配制250mL溶液,只能配置500mL溶液,故⑤错误;
⑥容量瓶上标有的是温度、容量、刻度线,故⑥正确;
故选:c.
点评 本题考查了物质的量浓度有关计算、一定物质的量浓度溶液的配制,明确物质的量浓度概念及计算公式,把握容量瓶构造及使用注意事项,配制一定物质的量浓度一般步骤是解题关键,题目难度不大.

| A. | 加入催化剂,改变了反应的途径,加快了反应速率,反应的△H也之改变 | |
| B. | 改变压强,反应速率发生改变,但平衡不发生移动,反应放出的热量不变 | |
| C. | 温度降低,正、逆反应速率都减小,反应放出的热量不变 | |
| D. | 恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
 于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )
于2016年9月15日发射的“天宫二号”空间实验室的供电系统中有再生氢氧燃料电池,工作原理如图所示,下列说法正确的是( )| A. | 当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2 | |
| B. | 左端装置中化学能转化为电能,右端装置中电能转化为化学能 | |
| C. | c极上发生的电极反应是:O2+2H2O+4e-=4OH- | |
| D. | d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A池 |
| A. | 2,3-二甲基-2-乙基己烷 | B. | CH3CH2CH2Cl氯丙烷 | ||
| C. |  属于芳香醇 属于芳香醇 | D. |  属于芳香化合物 属于芳香化合物 |
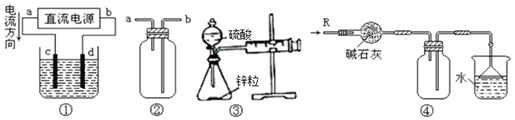
| A. | 装置①中,d为阳极、c为阴极 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 | |
| C. | 装置③结合秒表可测量锌与硫酸的反应速率 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
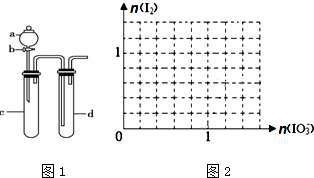
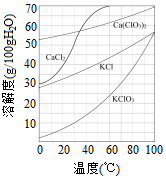 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为: