题目内容
9.(1)某化学小组利用图1装置进行实验证明氧化性:KMnO4>Cl2>Br2.限选试剂:KBr溶液、KMnO4、浓盐酸、浓硫酸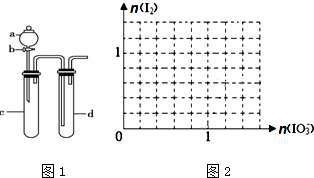
装置a、d中盛放的试剂分别是:浓盐酸、KBr溶液;实验中观察到的现象为c中有黄绿色气体产生,d中溶液变为棕黄色;此实验装置的不足之处是无尾气处理装置.
(2)已知:还原性HSO3?>I?,氧化性IO3?>I2,在图2中画出向含3mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线.
(3)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式:MnO2+4HSCN(浓)=Mn(SCN)2+(SCN)2↑+2H2O
②(CN)2和NaOH溶液反应的离子方程式:CN)2+2OH-=CN-+CNO-+H2O
(4)已知H2O2是二元弱酸、请写出H2O2与Ca(OH)2溶液反应生成酸式盐的化学式Ca(HO2)2.
分析 (1)根据在氧化还原反应中,氧化剂的氧化性强于氧化产物,故要实验证明氧化性;KMnO4>Cl2>Br2,需用KMnO4将Cl2氧化出,用Cl2将Br2氧化出,据此分析;根据反应来分析现象;由于氯气、溴蒸汽有毒,故应有尾气处理;
(2)还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,由反应可知,可知NaHSO3完全反应需要3mol×$\frac{2}{6}$=1molKIO3,而n(I2)达到最大值时,由IO3-+6H++5I-=3H2O+3I2可知,此时共加入1.2molKIO3,生成I2为0.2mol×3=0.6mol,以此来解答;
(3)根据MnO2和盐酸的反应和氯气与KOH溶液的反应,类推反应;
(4)H2O2与Ca(OH)2作用形成酸式盐为Ca(HO2)2,同时生成水.
解答 解:(1)根据在氧化还原反应中,氧化剂的氧化性强于氧化产物,故要实验证明氧化性;KMnO4>Cl2>Br2,需用KMnO4将Cl2氧化出,用Cl2将Br2氧化出,故a中应放浓盐酸,c中放KMnO4溶液,通过KMnO4能将浓盐酸中的Cl-氧化为Cl2可证明氧化性KMnO4>Cl2;d中放KBr溶液,通过Cl2与KBr溶液反应置换出Br2可以证明氧化性Cl2>Br2,
由于c中有氯气生成,即有黄绿色气体产生,在d中氯气将KBr溶液氧化为单质溴,溶液变为棕黄色.由于氯气、溴蒸汽有毒,故应有尾气处理装置.
故答案为:浓盐酸;KBr溶液;c中有黄绿色气体产生,d中溶液变为棕黄色;无尾气处理装置;
(2)还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,由反应可知,可知NaHSO3完全反应需要3mol×$\frac{2}{6}$=1molKIO3,而n(I2)达到最大值时,由IO3-+6H++5I-=3H2O+3I2可知,此时共加入1.2molKIO3,生成I2为0.2mol×3=0.6mol,则图象为 ,故答案为:
,故答案为: ;
;
(3)①由二氧化锰和浓盐酸的反应可知MnO2和HSCN反应的化学方程式为:MnO2+4HSCN(浓)=Mn(SCN)2+(SCN)2↑+2H2O;
故答案为:MnO2+4HSCN(浓)=Mn(SCN)2+(SCN)2↑+2H2O;
②由Cl2+2KOH=KCl+KClO+H2O可知,(CN)2的化学性质和卤素很相似,则(CN)2与KOH(aq)反应的化学方程式为(CN)2+2KOH=KCN+KCNO+H2O,离子方程式为(CN)2+2OH-=CN-+CNO-+H2O;
故答案为:(CN)2+2OH-=CN-+CNO-+H2O;
(4)H2O2为二元酸,其第一步电离方程式为H2O2?H++HO2-,则H2O2与Ca(OH)2作用形成酸式盐为Ca(HO2)2,同时生成水;
故答案为:Ca(HO2)2.
点评 本题考查化学反应方程式的书写,明确信息及离子的还原性与反应的关系即可解答,(2)中注意优先氧化为学生解答的难点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案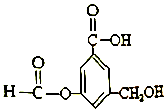
| A. | A 与金属钠完全反应时,两者反应的物质的量之比为1:3 | |
| B. | lmolA最多能与5mol氢气发生反应,反应类型是加成反应 | |
| C. | 1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol | |
| D. | A既能与羧基反应,又能与醇反应,还能发生水解反应和缩聚反应 |
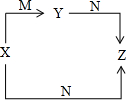 X.Y、Z、M、N五种物质中,X、Y、Z中均含有钠元素,X和M都是常见的单质,N是水,它们之间具有如图所示的转化关系.下列有关物质的推断不正确的是( )
X.Y、Z、M、N五种物质中,X、Y、Z中均含有钠元素,X和M都是常见的单质,N是水,它们之间具有如图所示的转化关系.下列有关物质的推断不正确的是( )| A. | X只是钠 | B. | Y只是Na2O | C. | Z只是NaOH | D. | M可能是O2 |
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
①该反应在常温下不能自发进行(填“能”与“不能”);
②一定温度和压强下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bd(填序号)
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表两组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO | H2O | H2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 3 |
②已知800℃时,上述反应的平衡常数K=1.若用2molCO和5mol H2O相互混合并加热到800℃,反应达到平衡时下列说法正确的是B(填序号)
A.此时水的转化率为71.4%
B.此时CO2的体积分数为20.4%
C.若再向容器内通入5mol H2O,则达到新平衡时,H2O的转化率升高
D.若从容器内移走5mol H2O,则达到新平衡时,CO的转化率升高.
| A. | HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | |
| B. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| C. | ⅠA金属元素是同周期中金属性最强的元素 | |
| D. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| A. | 酒精和水 | B. | 植物油和水 | ||
| C. | 四氯化碳和稀硫酸 | D. | 氢氧化钠溶液和四氯化碳 |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.