题目内容
3.氯气是一种有毒气体,在运输和储存过程中,如果发生泄漏,必须立即采取有效措施.下列措施不合理的是( )| A. | 将人群向高处疏散 | |
| B. | 将人群向顺风方向疏散 | |
| C. | 用浸有水或肥皂水(弱碱性)的毛巾捂住口鼻 | |
| D. | 向泄漏地点撒一些石灰 |
分析 氯气是一种有毒气体,其密度大于空气,且能和水反应生成盐酸和次氯酸,盐酸和次氯酸都能和碱反应生成盐,据此分析解答.
解答 解:A.氯气的密度大于空气密度,所以氯气泄漏时,要人群向高处疏散,故A正确;
B.氯气向顺风方向扩散较快,所以应将人群逆风向疏散,故B错误;
C.氯气能和碱反应生成盐,用浸有水或肥皂水(弱碱性)的毛巾捂住口鼻,可以吸收氯气,故正确;
D.氯气和水反应生成的酸能和石灰反应,吸收氯气,故D正确;
故选:B.
点评 本题考查了氯气的性质,熟悉氯气的物理、化学性质是解题关键,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
13.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
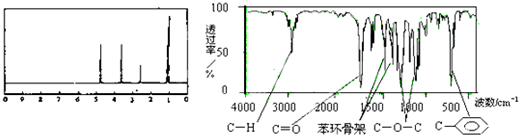

| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | 符合题中A分子结构特征的有机物有两种 | |
| C. | A在一定条件下可与3 mol H2发生加成反应 | |
| D. | 分子式为C8H8O2且分子中含苯环和-COOR(-R为烃基)的物质共有6种 |
14.Ⅰ.在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S< 0(填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤.
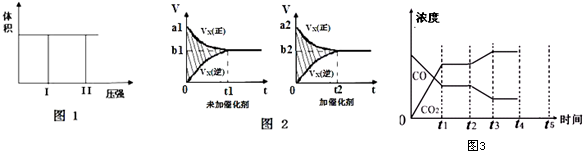
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示.下列说法正确的是BD.
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是AD.
A.2c1=c2=c3 B.2Q1=Q2=Q3 C.α1=α2=α3 D.α1+α2=1
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是升高温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S< 0(填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤.

①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示.下列说法正确的是BD.
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是升高温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
11.下列关于实验的说法正确的是( )
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 燃料电池制作中,为了能吸附更多气体,在两根碳棒表面包上一层薄海绵 | |
| C. | 用硫代硫酸钠溶液和硫酸溶液反应测反应速率是实验中,可以通过判断气泡多少来比较反应速率快慢 | |
| D. | 酸碱中和滴定操作中,用酸润洗过的滴定管需要用蒸馏水再润洗一次 |
18.下列物质性质与应用对应关系不正确的是( )
| A. | 氯化钙是中性干燥剂,可用于实验室干燥氨气 | |
| B. | 二氧化氯具有强氧化性,可用于自来水的杀菌消毒 | |
| C. | 常温下,铝与浓硫酸发生钝化,可用铝槽车贮运浓硫酸 | |
| D. | 钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属 |
15.下列物质在水溶液中的电离方程式错误的是( )
| A. | Na2CO3═2Na++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KOH═K++O2-+H+ | D. | H2SO4═2H++SO42- |
12.下列物质中属于电解质的是( )
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
| A. | ①② | B. | ①②⑤ | C. | ③④ | D. | ①⑤ |
2.下列叙述正确的是( )
| A. | c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) | |
| B. | 室温下若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1 | |
| C. | 室温下0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | NaHCO3溶液中:c(OH-)═c(H+)+c(H2CO3)+c(HCO3-) |