题目内容
20.超细氮化铝粉末(AlN)被广泛应用于大规模集成电路生产领域.其制取原理为:Al2O3+3C+N2 $\stackrel{高温}{→}$2AlN+3CO.已知氮化铝能与水反应生成氢氧化铝和氨气.(1)某化学研究性学习小组认为在制取氮化铝时由于反应不完全,氮化铝产品中可能存在碳、氧化铝等杂质.为测定氮化铝样品中AlN的含量,甲、乙两同学设计了以下两个实验:
I.甲同学设计测定氨气的质量,可能需要的仪器和试剂如下:
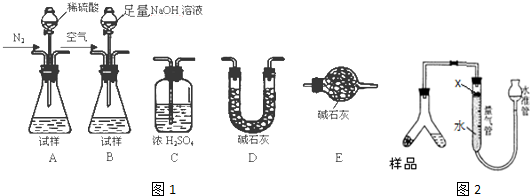
(2)请写出发生装置如图1中产生氨气的化学方程式:AlN+NaOH+H2O=NaAlO2+NH3↑
(3)请选择合适的药品和装置,按气流方向连接各装置,其顺序为:B→D→C→E
II.乙同学设计通过以下装置测定氨气的体积
(4)如图2量气管中的试剂X可选用ac(填选项的标号).
a.苯 b.酒精 c.植物油 d.CCl4
(5)若量气管中的液体没有装满(上方留有少量空间),实验测 得NH3的体积将不变(填偏大、偏小或不变).若读数时,量气管中的液面低于水准管的液面,实验测得NH3的体积将偏小.(填“偏大”、“偏小”或“不变”).
(6)若样品为mg,氨气的体积为a mL(标况下),则样品中AlN的质量分数为$\frac{41a}{224w}$%.
分析 I.(1)制备反应原理可知,Al2O3+3C+N2 $\stackrel{高温}{→}$2AlN+3CO,若反应不完全,会含有固体杂质碳、氧化铝;
(2)由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,据此生成方程式;
(3)根据实验原理,测定氨气的质量,可以先用碱溶液与样品反应,将生成的氨气先用碱石灰干燥,再用浓硫酸吸收,为防止空气的水份被浓硫酸吸收,在浓硫酸装置后面再连一个装有碱石灰 的干燥管;
II.(4)图2是用排液体的量气方法,由于氨气极易溶于水,所以在水的上面应放少量有机物,该有机物的密度应小于水;
(5)若量气管中的液体上方留有少量空间对测得NH3的体积将没有影响,读数时应保持量气管和水准管两边的液面高度一样,如果量气管中的液面低于水准管的液面,则产生的氨气的受到的压强大于空气中的压强,使测得NH3的体积会偏小;
(6)计算出氨气的体积为amL(标况下)的物质的量,再根据方程式计算出AlN的物质的量,进而计算AlN的质量,利用质量分数的定义计算样品中AIN的质量分数.
解答 解:I.(1)制备反应原理可知,Al2O3+3C+N2 $\stackrel{高温}{→}$2AlN+3CO,若反应不完全,会含有固体杂质碳、氧化铝,故答案为:碳;氧化铝;
(2)由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)根据实验原理,测定氨气的质量,可以先用碱溶液与样品反应,将生成的氨气先用碱石灰干燥,再用浓硫酸吸收,为防止空气的水份被浓硫酸吸收,在浓硫酸装置后面再连一个装有碱石灰 的干燥管,所以按气流方向连接各装置,其顺序为:B→D→C→E,
故答案为:B;D;C;
II.(4)图2是用排液体的量气方法,由于氨气极易溶于水,所以在水的上面应放少量有机物,该有机物的密度应小于水且难溶于水,故选ac;
(5)若量气管中的液体上方留有少量空间对测得NH3的体积将没有影响,读数时应保持量气管和水准管两边的液面高度一样,如果量气管中的液面低于水准管的液面,则产生的氨气的受到的压强大于空气中的压强,使测得NH3的体积会偏小,
故答案为:不变;偏小;
(6)氨气的体积为amL(标况下)的物质的量为 $\frac{a×10{\;}^{-3}L}{22.4L/mol}$=$\frac{a×1{0}^{-3}}{22.4}$mol,由方程式AlN+NaOH+H2O=NaAlO2+NH3↑可知,样品中AlN的物质的量为$\frac{a}{22.4}$×10-3 mol,所以AlN的质量为 $\frac{a}{22.4}$×10-3mol×41g/mol=$\frac{41a×1{0}^{-3}}{22.4}$g,样品中AIN的质量分数为$\frac{\frac{41a×1{0}^{-3}}{22.4}}{w}$×100%=$\frac{41a}{224w}$%,
故答案为:$\frac{41a}{224w}$%.
点评 该题为典型的样品纯度测验试题,并要求对已有的实验方案的评价,并指出方案不可行的原因以及在已有实验的基础上进行新的实验设计,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识,难度很大.


| A. | 锌是正极,铜是负极,电流的方向是从锌到铜 | |
| B. | 锌片质量减少,铜片质量增加 | |
| C. | 正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池中的能量变化是:化学能转化为电能 |
| A. | 烟雾 | B. | 稀豆浆 | C. | 蒸馏水 | D. | 血液 |
| A. | 乙醇的官能团是:-OH | B. | 乙醇的分子式是:CH3CH2OH | ||
| C. | 乙烯的结构简式是:CH2CH2 | D. | 乙烯无官能团 |
| A. | 臭氧层破坏 | B. | 温室效应 | C. | 酸雨 | D. | 光化学烟雾 |
| A. | 提高硫酸厂尾气的回收效率 | |
| B. | 强制燃煤企业完善脱硫设备 | |
| C. | 用天然气代替含硫的煤作民用燃料 | |
| D. | 减少全球工业化生产过程的CO2气体年排放总量 |
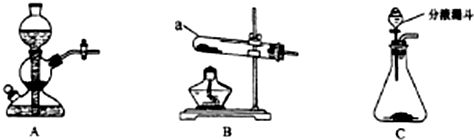
(1)仪器a的名称是试管;搭建B装置时,酒精灯应在固体仪器a之前(选填“前”或“后”)放置.
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)在实验室制取二氧化碳的研究中,进行了如下实验:
| 实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号).
③除盐酸的浓度外,上述实验研究的另一个影响反应因素是固体反应物的颗粒大小(或反应物的接触面积).
④研究发现酸的浓度越大,产生气体的速度越快.与甲比较,对丁分析正确的是ab.(选填编号)
a.反应更为剧烈 b.最终剩余溶液的质量更小
c.产生二氧化碳的质量更大 d.粉末状大理石利用率更高.
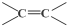 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$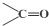 +
+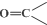
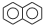 ,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).
,C10H8)的衍生物,其可能具有的化学性质有bd(选填编号).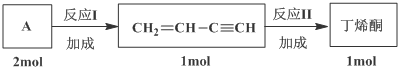
 .
.