题目内容
16.下列说法正确的是( )| A. | 铅蓄电池在充电过程中,阴极得到电子质量增加 | |
| B. | 1 mol羟基含电子数约为7×6.02×1023 | |
| C. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
分析 A.铅蓄电池放电时,负极电极反应式为:Pb+SO42--2e-=PbSO4 ,正极电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,所以正负极质量都增加,充电与放电相反;
B.羟基中含有9个电子,1mol羟基中含有9个电子;
C.根据醋酸的电离平衡常数可知:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c({H}^{+})}{{K}_{a}}$,结合稀释过程中氢离子浓度减小分析;
D.加入少量Ca(OH)2固体后,反应生成氢氧化钠,溶液的pH增大.
解答 解:A.铅蓄电池放电时,负极电极反应式为:Pb+SO42--2e-=PbSO4 ,正极电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,所以正负极质量都增加,充电与放电相反,阴极和阳极质量都减小,故A错误;
B.1 mol羟基中含有9mol电子,含电子数约为9×6.02×1023,故B错误;
C.设醋酸的电离平衡常数为Ka,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c({H}^{+})}{{K}_{a}}$,稀释过程中氢离子浓度减小,则溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小,故C正确;
D.Na2CO3溶液中加入少量Ca(OH)2固体,反应生成碳酸钙沉淀和NaOH,溶液的pH增大,故D错误;
故选C.
点评 本题考查较为综合,涉及弱电解质的电离平衡及其影响、溶液酸碱性与溶液pH的关系、原电池原理等知识,题目难度中等,明确电离平衡及其影响为解答关键,注意掌握原电池、电解池工作原理,试题培养了学生的灵活应用能力.

| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | Na2CO3溶液中滴加几滴稀盐酸:CO32+H+=HCO3- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
| A. | 元素X与Z同主族 | |
| B. | 原子半径:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 由元素X,Y,Z形成的常见化合物为共价化合物 | |
| D. | 最简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
| A. | Na、Mg、Al 的第一电离能逐渐增大 | B. | O、F、N 的电负性逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐增大 | D. | 热稳定性:HF>H2O>NH3 |
| A. | 原子半径:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y与Z 两种元素只能形成一种化合物 | |
| C. | 最高价氧化物对应水化物的碱性:Z<W | |
| D. | X的简单气态氢化物的热稳定性比Y的强 |
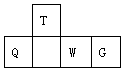 短周期元素T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A. | 原子半径:W<T | |
| B. | 最简单气态氢化物的热稳定性:Q<T | |
| C. | 最高价氧化物对应水化物的酸性:W<Q | |
| D. | 简单离子的还原性:W<G |
| A. | 加入过量NaOH溶液:Na+、NH4+、SO42-、OH- | |
| B. | 加入过量KI溶液:K+、Fe2+、NH4+、SO42-、I- | |
| C. | 加入过量BaCl2溶液:Ba2+、NH4+、Fe3+、SO42-、Cl- | |
| D. | 加入过量KSCN溶液:K+、NH4+、Fe3+、SO42-、SCN- |