题目内容
9.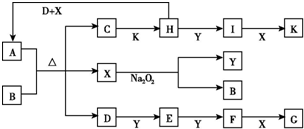 如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题:
如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题:(1)写出D(少量)、H、X反应生成A的离子反应方程式:NH3+SO2+H2O=NH4++HSO3-.
(2)写出D与Y反应生成E的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)写出D与K反应生成的正盐溶液中的离子浓度大小关系:c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(4)已知:2H(g)+Y(g)?2I(g)△H=-196.6 kJ•mol-1.当加入4mol H和2mol Y后,放出345 kJ的热量时,H的转化率最接近于D(填字母).
A.40% B.50% C.80% D.90%
分析 X为无色液体,与过氧化钠反应得到B与气体Y,则X是H2O,Y是O2,B是NaOH.A能与氢氧化钠反应生成气体D,且D为10电子分子,可判断A为铵盐,D为NH3;C与强酸K反应,生成气体H,且H能与Na2O2发生化合反应,可判断H具有还原性,H的氧化产物能与Ba2+生成难溶于酸的沉淀,可知该沉淀是BaSO4,据此逐步推出,A为NH4HSO3,C为Na2SO3,H为SO2,I为SO3,K为硫酸;由D到G的转化过程可判断,E为NO,F为NO2,G为HNO3,据此解答.
解答 解:X为无色液体,与过氧化钠反应得到B与气体Y,则X是H2O,Y是O2,B是NaOH.A能与氢氧化钠反应生成气体D,且D为10电子分子,可判断A为铵盐,D为NH3;C与强酸K反应,生成气体H,且H能与Na2O2发生化合反应,可判断H具有还原性,H的氧化产物能与Ba2+生成难溶于酸的沉淀,可知该沉淀是BaSO4,据此逐步推出,A为NH4HSO3,C为Na2SO3,H为SO2,I为SO3,K为硫酸;由D到G的转化过程可判断,E为NO,F为NO2,G为HNO3.
(1)亚硫酸属于二元酸,NH3少量时生成酸式盐,反应离子方程式为:NH3+SO2+H2O=NH4++HSO3-,
故答案为:NH3+SO2+H2O=NH4++HSO3-;
(2)NH3在催化剂存在下可被O2氧化为NO,这是工业生成硝酸的基础,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)NH3与硫酸反应生成(NH4)2SO4,铵根离子部分水解使溶液呈酸性,故溶液中的离子浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)根据热化学反应方程式可知,4 mol SO2与2 mol O2完全反应放出的热量为:196 kJ×2=392 kJ,实际放出的热量为345 kJ,故SO2的转化率为:345 kJ/392 kJ=0.88,故选:D.
点评 本题考查无机物土地,突破点为X(无色液体)与Na2O2反应生成Y(气体)和B,需要学生熟练掌握元素化合物知识,注意根据转化关系中特殊反应进行推断,难度中等.

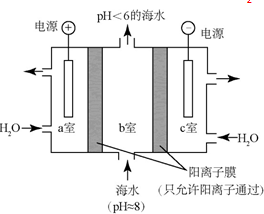
| A. | a室的电极接电源的负极 | |
| B. | 该装置将电能转化为化学能 | |
| C. | c室排出的碱液中含有NaOH | |
| D. | a室的电极反应式为:4OH--4e-═2H2O+O2↑ |
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,溴苯和水,苯酚和酒精 |
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,在选择萃取剂时,要求萃取剂和原溶剂不互溶 |
| 实验目的 | 实验操作 | |
| A | 鉴别Al3+和Fe3+ | 分别加入少量NaOH溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
| D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 电流表指针不发生偏转 | |
| B. | Al、Pt两极有H2产生 | |
| C. | Mg、C两极生成的气体可以恰好完全反应 | |
| D. | 甲池pH减小,乙池pH不变 |
(1)我国科学家包信和院士领衔的团队,创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产链烃X、芳烃Y和Z等重要化工原料,反应过程本身实现了CO2的零排放,碳原子利用效率达到100%.若X、Y、Z的相对分子质量分别为28、78、128,且X、Y的核磁共振氢谱只有一个峰,Z的核磁共振氢谱有二个峰.
①有关化学键键能数据如下:
| 化学键 | H-H | C═C | C-C | C≡C | C-H |
| E/(kJ•mol-1) | 436.0 | 615 | 347.7 | 812 | 413.4 |
硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率.
②甲烷生成芳烃Y的原子利用率为81.25%.
③Z的结构简式为(CH3)3CCH2C(CH3)3,其二氯取代物有6种.
(2)碳酸乙二醇酯在锂电池中有重要用途.已知:

①请以CO2、X、空气为原料,利用绿色化学原则制备碳酸乙二醇酯,写出有关反应的化学方程式
 、
、 .
.②生产1t碳酸乙二醇酯在理论上可以吸收0.5t CO2.
| A. | 单质的还原性:Y>X | |
| B. | 元素M与N只能形成一种化合物 | |
| C. | 元素Z的单质不能与元素N的氢化物反应 | |
| D. | 元素X、Y的最高氧化物对应的水化物可发生反应 |
 .
. .②E→Fn
.②E→Fn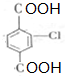 +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$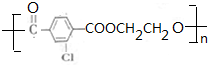 +2nH2O.
+2nH2O. 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.