题目内容
某可降解塑料的单体为A,经测定A的相对分子质量在90~120之间,其中含碳的质量分数为46.2%,含氢的质量分数为7.7%,其余为氧.请回答下列问题:
(1)A的分子式为 .
(2)1molA与足量NaHCO3反应得到22.4L(标准状况下)CO2,与足量金属钠反应,得到22.4L(标准状况下)H2;在一定条件下,A也能发生反应生成五元环,则A的结构简式为 .A反应成五元环反应方程式为: .
(3)一定条件下A聚合成可降解塑料的化学方程式为 .
(1)A的分子式为
(2)1molA与足量NaHCO3反应得到22.4L(标准状况下)CO2,与足量金属钠反应,得到22.4L(标准状况下)H2;在一定条件下,A也能发生反应生成五元环,则A的结构简式为
(3)一定条件下A聚合成可降解塑料的化学方程式为
考点:有关有机物分子式确定的计算,化学方程式的书写
专题:
分析:(1)根据A的相对分子质量在90~120之间,其中含碳的质量分数为46.2%,碳的质量分数=
×100%来计算碳原子的数目,根据各元素原子的百分含量确定原子的个数比,进而确定分子式即可;
(2)根据有机物中可以喝碳酸氢钠反应的只有羧酸,且羧基和羟基均可以和金属钠反应生产氢气,据有机物的量和产生氢气的量来确定有机物的官能团;含有羧基和羟基的有机物可以自身发生分子内酯化反应生成环状酯,据此来回答;
(3)含有羟基和羧基的物质可以发生缩聚反应.
| 12×碳原子个数 |
| 相对分子质量 |
(2)根据有机物中可以喝碳酸氢钠反应的只有羧酸,且羧基和羟基均可以和金属钠反应生产氢气,据有机物的量和产生氢气的量来确定有机物的官能团;含有羧基和羟基的有机物可以自身发生分子内酯化反应生成环状酯,据此来回答;
(3)含有羟基和羧基的物质可以发生缩聚反应.
解答:
解:(1)A的相对分子质量在90~120之间,含有碳原子:
=3.5,
=4.6,所以A中含有4个碳原子,A的相对分子质量=
=104,分子中含有H原子:104×7.7%=8,含有氧原子
=3,A的分子式为C4H3O3,故答案为:C4H8O3;
(2)1molA与足量NaHCO3反应得到22.4L(标准状况下)CO2,所以其中含有一个羧基,1molA可以与足量金属钠反应得到22.4L(标准状况下)H2,所以分子中含有一个羧基和一个羟基两种官能团,在一定条件下,A中含有羧基和羟基,可发生反应生成五元环,说明A中不含支链且羟基在端碳位置,所以A的结构简式为:HOCH2CH2CH2COOH,羟基和羧基之间可以发生酯化反应,得到环酯,反应方程式为:HOCH2CH2CH2COOH
 +H2O,
+H2O,
故答案为:HOCH2CH2CH2COOH;HOCH2CH2CH2COOH
 +H2O;
+H2O;
(3)含有羟基和羧基的物质可以发生缩聚反应,A聚合成可降解塑料的化学方程式为:nHOCH2CH2CH2COOH
 +(n-1)H2O,故答案为:nHOCH2CH2CH2COOH
+(n-1)H2O,故答案为:nHOCH2CH2CH2COOH
 +(n-1)H2O.
+(n-1)H2O.
| 90×46.2% |
| 12 |
| 120×46.2% |
| 12 |
| 4×12 |
| 46.2% |
| 104-48-8 |
| 16 |
(2)1molA与足量NaHCO3反应得到22.4L(标准状况下)CO2,所以其中含有一个羧基,1molA可以与足量金属钠反应得到22.4L(标准状况下)H2,所以分子中含有一个羧基和一个羟基两种官能团,在一定条件下,A中含有羧基和羟基,可发生反应生成五元环,说明A中不含支链且羟基在端碳位置,所以A的结构简式为:HOCH2CH2CH2COOH,羟基和羧基之间可以发生酯化反应,得到环酯,反应方程式为:HOCH2CH2CH2COOH
| 浓硫酸 |
| △ |
 +H2O,
+H2O,故答案为:HOCH2CH2CH2COOH;HOCH2CH2CH2COOH
| 浓硫酸 |
| △ |
 +H2O;
+H2O;(3)含有羟基和羧基的物质可以发生缩聚反应,A聚合成可降解塑料的化学方程式为:nHOCH2CH2CH2COOH
| 一定条件下 |
 +(n-1)H2O,故答案为:nHOCH2CH2CH2COOH
+(n-1)H2O,故答案为:nHOCH2CH2CH2COOH| 一定条件下 |
 +(n-1)H2O.
+(n-1)H2O.
点评:本题考查有机物分子式确定及性质,注意知识的梳理和归纳是解题的关键,难度较大.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
结合如图判断,下列叙述正确的是( )


| A、Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| B、Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C、Ⅰ和Ⅱ中正极均被保护 |
| D、Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
某种干洗剂的主要成分是四氯乙烯,对人体有害.家用不粘锅内涂覆物质的主要成分是聚四氟乙烯,对人体无害.下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是( )
| A、它们都属于高分子化合物 |
| B、它们的分子中都不含氢原子 |
| C、它们都能使酸性KMnO4溶液褪色 |
| D、它们都可由乙烯只发生加成反应得到 |
煤矿一旦发生爆炸事故,会造成重大人员伤亡和财产损失.煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷.下列关于甲烷的叙述中错误的是( )
| A、“西气东输”中的天然气的主要成分为甲烷 |
| B、甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 |
| C、甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
| D、“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
利用下列实验装置及药品(依次为①-④)能完成相应实验的是( )
A、 实验测定化学反应速率 |
B、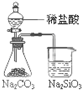 能证明非金属性 Cl>C>Si |
C、 实验制取并收集NH3 |
D、 滴定法测定盐酸浓度 |
铝制器皿不易被腐蚀的原因是( )
| A、铝不易发生化学反应 |
| B、铝的氧化物难溶于酸和碱 |
| C、铝密度小 |
| D、铝器表面致密氧化膜对内部铝具有保护作用 |

