题目内容
结合如图判断,下列叙述正确的是( )


| A、Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| B、Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C、Ⅰ和Ⅱ中正极均被保护 |
| D、Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、Ⅱ中正极上氢离子放电;
B、负极上都是金属Fe放电;
C、Ⅰ、Ⅱ中负极Fe放电,被腐蚀;
D、Fe2+离子可与K3[Fe(CN)6]反应生成蓝色的Fe3[Fe(CN)6]2沉淀.
B、负极上都是金属Fe放电;
C、Ⅰ、Ⅱ中负极Fe放电,被腐蚀;
D、Fe2+离子可与K3[Fe(CN)6]反应生成蓝色的Fe3[Fe(CN)6]2沉淀.
解答:
解:A、Ⅰ中正极反应是O2+2H2O+4e-=4OH-,Ⅱ中正极上氢离子放电,故A错误;
B、负极上都是金属Fe放电生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故B正确;
C、Ⅰ、Ⅱ中负极Fe放电,被腐蚀,故C错误;
D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错误;
故选B.
B、负极上都是金属Fe放电生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故B正确;
C、Ⅰ、Ⅱ中负极Fe放电,被腐蚀,故C错误;
D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错误;
故选B.
点评:本题考查了原电池的电极反应,注意Fe放电生成亚铁离子,Fe2+离子可与K3[Fe(CN)6]反应生成蓝色的Fe3[Fe(CN)6]2沉淀,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )
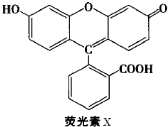

| A、1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH |
| B、1molX最多能与9mol氢气反应 |
| C、X与足量的浓溴水反应,最多消耗4molBr2 |
D、X能与糠醛(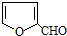 )发生缩聚反应 )发生缩聚反应 |
已知X、Y元素同周期,且第一电离能X>Y,下列说法不正确的是( )
| A、电负性Y小于X |
| B、X与Y形成化合物时,X显负价,Y显正价 |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| D、气态氢化物的稳定性:HmY小于HnX |
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )| A、通入CO2后,不能确定A烧杯中的溶质 |
| B、B烧杯中通入的CO2体积为448mL |
| C、原NaOH溶液的浓度为0.2mol/L |
| D、通入CO2后,C烧杯中溶质成分为NaOH和Na2CO3,且物质的量相等 |
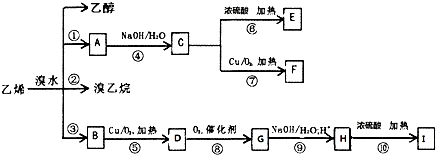
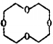 I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
I的分子式为C4H4O4,是一种环状化合物.请回答下列问题:
