题目内容
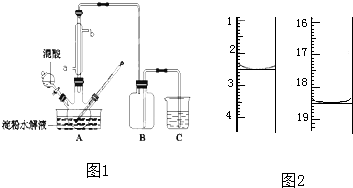
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶.现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲.(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)请填写表中空格,完成由上述混合物得到固体甲的实验设计
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入98%H2SO4,充分搅拌直至固体不再溶解 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 洗涤沉淀 | |
| ⑥ | 检验沉淀是否洗净 |
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸而乙不溶,可用浓硫酸溶解乙,采用过滤的方法分离,由于溶液为浓硫酸,所以使用的不是普通的滤纸,应为用于强酸性液体的耐酸性过滤器.再用水洗涤,即可得到不溶于浓硫酸的难溶性固体乙.另一种固体甲溶解在浓硫酸中,加水稀释甲的浓硫酸溶液,就可让甲从溶液中分离出来,然后过滤、洗涤可得到纯净的甲,以此解答该题.
解答:
解:化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸而乙不溶,可用浓硫酸溶解乙,采用过滤的方法分离,由于溶液为浓硫酸,所以使用的不是普通的滤纸,应为用于强酸性液体的耐酸性过滤器.再用水洗涤,即可得到不溶于浓硫酸的难溶性固体乙.另一种固体甲溶解在浓硫酸中,加水稀释甲的浓硫酸溶液,就可让甲从溶液中分离出来,然后过滤、洗涤可得到纯净的甲,
实验步骤为①溶解,将混合物放入烧杯中,加入98%H2SO4,充分搅拌直至固体不再溶解,
②过滤分离不溶物和可溶物,将烧杯中的混合液沿玻璃棒缓慢倒入过滤器中过滤,
③将②中的滤液沿玻璃棒缓慢倒入一盛有大量水的烧杯中,并不断搅拌,
④将③中稀释后的混合液沿玻璃棒缓慢倒入过滤器中过滤滤,
⑤直接向过滤器中加入蒸馏水洗涤沉淀,重复2-3次,
⑥收集最后一次洗涤的滤液,加入几滴BaCl2溶液,看有无沉淀生成,如果无沉淀生成,则表明已经洗净,否则,还要继续洗涤,
故答案为:
实验步骤为①溶解,将混合物放入烧杯中,加入98%H2SO4,充分搅拌直至固体不再溶解,
②过滤分离不溶物和可溶物,将烧杯中的混合液沿玻璃棒缓慢倒入过滤器中过滤,
③将②中的滤液沿玻璃棒缓慢倒入一盛有大量水的烧杯中,并不断搅拌,
④将③中稀释后的混合液沿玻璃棒缓慢倒入过滤器中过滤滤,
⑤直接向过滤器中加入蒸馏水洗涤沉淀,重复2-3次,
⑥收集最后一次洗涤的滤液,加入几滴BaCl2溶液,看有无沉淀生成,如果无沉淀生成,则表明已经洗净,否则,还要继续洗涤,
故答案为:
| ② | 过滤 | 安装好耐酸过滤器,将①的悬浊液沿玻璃棒加入过滤器中过滤 |
| ③ | 稀释(或析出沉淀) | 在另一烧杯中,放入适量蒸馏水,将②的滤液沿玻璃棒慢慢加入该烧杯中,并不断搅拌. |
| ④ | 过滤 | 重新安装过滤装置,将③的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑤ | 洗涤沉淀 | 向④的过滤器中注入适量蒸馏水,使水面漫过沉淀物,等水滤出后,再次加水洗涤,连洗几次. |
| ⑥ | 检验沉淀是否洗净 | 用小试管从⑤的漏斗下口取少量洗出液,滴入BaCl2溶液,没有白色沉淀出现,说明沉淀已洗净. |
点评:本题考查物质的分离提纯实验设计,为高频考点,侧重于学生的分析能力和实验能力的考查,明确物质的性质,选择相应的分离方法是解题的关键,题目难度不大.

练习册系列答案
相关题目
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得的溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示,下列判断正确的是( )| A、通入CO2后,不能确定A烧杯中的溶质 |
| B、B烧杯中通入的CO2体积为448mL |
| C、原NaOH溶液的浓度为0.2mol/L |
| D、通入CO2后,C烧杯中溶质成分为NaOH和Na2CO3,且物质的量相等 |
下列化学式只表示一种纯净物的是( )
| A、CH2Br2 |
| B、C3H6 |
| C、C4H10 |
| D、C |