题目内容
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.

(1)用SO2气体可以消除汽车尾气中NO2,已知NO2(g)+SO2(g)?SO3(g)+NO(g)
一定条件下,将NO2与SO2以体积比1:2置于体积为1L 密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= .
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器.NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ?mol-1.在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图1所示:
①有害气体NO的转化率为 ,0-15minNO的平均速率v(NO)= mol/(L?min).
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号).
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x= ,V甲:V乙=
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g)△H=-b kJ?mol-1;CO的燃烧热△H=-c kJ?mol-1.写处消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 .

(1)用SO2气体可以消除汽车尾气中NO2,已知NO2(g)+SO2(g)?SO3(g)+NO(g)
一定条件下,将NO2与SO2以体积比1:2置于体积为1L 密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器.NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ?mol-1.在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图1所示:
①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g)△H=-b kJ?mol-1;CO的燃烧热△H=-c kJ?mol-1.写处消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
考点:化学平衡的计算,热化学方程式,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)利用化学平衡的特征“等”、“定”来判定化学平衡,利用三段法计算平衡时的浓度来计算化学平衡常数;
(2)①根据氮气浓度计算参加反应的一氧化氮浓度,再根据转化率公式计算NO的转化率,根据v(NO)=
计算;
②若改变反应条件,导致CO浓度减小,可以采用改变温度或容器容积的方法;
③如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)?N2(g)+2CO2(g)只要转化到一边成比例即等效,若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,据此分析;
(3)根据盖斯定律进行解答.
(2)①根据氮气浓度计算参加反应的一氧化氮浓度,再根据转化率公式计算NO的转化率,根据v(NO)=
| △c |
| △t |
②若改变反应条件,导致CO浓度减小,可以采用改变温度或容器容积的方法;
③如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)?N2(g)+2CO2(g)只要转化到一边成比例即等效,若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,据此分析;
(3)根据盖斯定律进行解答.
解答:
解:(1)本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据.
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=
a,故平衡常数为=
=
;故答案为:b;
.
(2)①0~15min△C(N2)=0.2mol/L,同一可逆反应中,各物质浓度变化之比等于其计量数之比,所以△C(NO)=2△C(N2)=0.4mol/L,NO的转化率=
=40%;0~15min NO的平均速率v(NO)=
=0.027mol/(L?min),
故答案为:40%;0.027;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但平衡时CO浓度大于第一次平衡浓度,故错误;
b.增加CO的量,平衡向正反应方向移动,但CO的转化率减小,所以CO的浓度增大,故错误;
c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度小于第一次平衡浓度,故正确;
故选c d;
③如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)?N2(g)+2CO2(g)只要转化到一边成比例即等效,所以有
2CO(g)+2NO(g)?N2(g)+2CO2(g);
甲起始(mol):0.8 0 x 4
转化(mol):0.8+2x 2x 0 4-2x
乙起始(mol):2.4 2 0 0
若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,则4-2x=0,解得x=2mol,
则甲相等于4molCO和4.8molNO刚好是乙的2倍,所以V甲:V乙=2:1,故答案为:2mol;2:1;
(3)①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ?mol-1
②2NO(g)+O2(g)=2NO2(g)△H=-b kJ?mol-1;
③CO(g)+
O2(g)=CO2(g)△H=-c kJ?mol-1
将方程式①-②+2③得4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-a+b-2c kJ?mol-1,
故答案为:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-a+b-2c kJ?mol-1.
NO2(g)+SO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)起始物质的体积 1a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 1a-x 2a-x x x
则(1a-x):(2a-x)=1:6,故x=
| 4 |
| 5 |
| x 2 |
| (1a-x)(2a-x) |
| 8 |
| 3 |
| 8 |
| 3 |
(2)①0~15min△C(N2)=0.2mol/L,同一可逆反应中,各物质浓度变化之比等于其计量数之比,所以△C(NO)=2△C(N2)=0.4mol/L,NO的转化率=
| ||
| 2L |
| 0.4mol/L |
| 15min |
故答案为:40%;0.027;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但平衡时CO浓度大于第一次平衡浓度,故错误;
b.增加CO的量,平衡向正反应方向移动,但CO的转化率减小,所以CO的浓度增大,故错误;
c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度小于第一次平衡浓度,故正确;
故选c d;
③如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)?N2(g)+2CO2(g)只要转化到一边成比例即等效,所以有
2CO(g)+2NO(g)?N2(g)+2CO2(g);
甲起始(mol):0.8 0 x 4
转化(mol):0.8+2x 2x 0 4-2x
乙起始(mol):2.4 2 0 0
若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,则4-2x=0,解得x=2mol,
则甲相等于4molCO和4.8molNO刚好是乙的2倍,所以V甲:V乙=2:1,故答案为:2mol;2:1;
(3)①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ?mol-1
②2NO(g)+O2(g)=2NO2(g)△H=-b kJ?mol-1;
③CO(g)+
| 1 |
| 2 |
将方程式①-②+2③得4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-a+b-2c kJ?mol-1,
故答案为:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=-a+b-2c kJ?mol-1.
点评:本题考查了化学平衡的有关计算以及盖斯定律的应用,根据反应速率、转化率公式计算NO的反应速率、转化率,利用平衡移动原理分析平衡移动,难度不大.

练习册系列答案
相关题目
根据如图,下列判断中正确的是( )


| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |
下列各组反应中最终肯定有白色沉淀的是( )
| A、向饱和碳酸钠溶液中通入过量CO2 |
| B、氯化亚铁溶液中加入少量过氧化钠 |
| C、AlCl3溶液中加入过量氢氧化钠溶液 |
| D、氯化钙溶液中通入过量CO2 |
下列说法不正确的是( )
| A、二氧化硅是生产光纤制品的基本原料 |
| B、水玻璃可用于生产黏合剂和防火剂 |
| C、涂油层、通过电镀加上金属层、制成合金等都是保护金属的措施 |
| D、相同条件下,溶液中Cu2+、Zn2+、H+、Na+的氧化性依次减弱 |
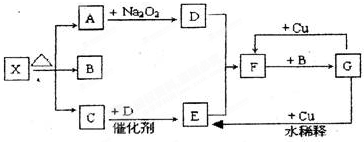
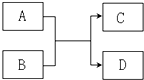 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系: 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通. 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: