题目内容
在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ/mol.起始反应时NO和CO各为4mol,10秒后达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
| A、反应前5秒钟内,用NO表示的平均反应速率为0.1mol/(L?s) |
| B、达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
| C、达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2) |
| D、保持容器体积不变,往容器中充入1molO2,正、逆反应速率都不改变 |
考点:反应速率的定量表示方法
专题:
分析:A、根据v=
计算前10内v(N2),再利用速率之比等于化学计量数之比计算前10s内v(NO),前5s反应物的浓度更大,反应速率更快,故前5s的平均速率大于前10s的平均速率;
B、升高温度正逆反应速率都增大;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比;
D、NO与氧气反应,NO浓度降低,反应物的浓度降低,正反应速率降低.
| △c |
| △t |
B、升高温度正逆反应速率都增大;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比;
D、NO与氧气反应,NO浓度降低,反应物的浓度降低,正反应速率降低.
解答:
解:A、前10秒钟内,v(N2)=
=0.05mol/(L?s),速率之比等于化学计量数之比,故前10s内v(NO)=2v(N2)=2×0.05mol/(L?s)=0.1mol/(L?s),前5s反应物的浓度更大,反应速率更快,故前5s的平均速率大于前10s的平均速率,即前5秒钟内,用NO表示的平均反应速率大于0.1mol/(L?s),故A错误;
B、升高温度正、逆反应速率都增大,故B错误;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比,v正(CO)=2v逆(N2)时正、逆速率之比等于化学计量数之比,说明反应到达平衡状态,故C正确;
D、NO与氧气反应,NO浓度降低,瞬间反应物的浓度降低,正反应速率降低,故D错误;
故选:C.
| ||
| 10s |
B、升高温度正、逆反应速率都增大,故B错误;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比,v正(CO)=2v逆(N2)时正、逆速率之比等于化学计量数之比,说明反应到达平衡状态,故C正确;
D、NO与氧气反应,NO浓度降低,瞬间反应物的浓度降低,正反应速率降低,故D错误;
故选:C.
点评:本题考查化学反应速率计算与影响因素、化学平衡状态判定、影响化学平衡的因素等,难度中等,注意A中,开始反应物的浓度最大,反应速率最快.

练习册系列答案
相关题目
氯仿(CHCl3)可作全身麻醉剂,但在光照下易被氧化生成光气(COCl2):2CHCl3+O2
2COCl2+2HCl.COCl2易爆炸,为防止事故,使用前应先检验是否变质,你认为检验用的最佳试剂是( )
| 光 |
| A、烧碱溶液 |
| B、溴水 |
| C、AgNO3溶液 |
| D、淀粉KI试剂 |
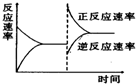 如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )
如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )| A、升高温度,同时加压 |
| B、降低温度,同时减压 |
| C、增大反应物浓度,同时使用催化剂 |
| D、增大反应物浓度,同时减小生成物浓度 |
除去下列物质中少量杂质的方法正确的是( )
| A、除去苯中溶有的少量苯酚,加入稍过量浓溴水反应过滤 |
| B、除去溴乙烷中混有的溴杂质,加入适量NaOH溶液,振荡分液 |
| C、除去Na2CO3晶体中混有的NaHCO3杂质,置于坩埚中充分加热 |
| D、除去KNO3晶体中混有的NaCl杂质,加水溶解、蒸发结晶、过滤 |
油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯.油脂的以下性质和用途与其含有的不饱和双键(碳碳双键)有关的是( )
| A、适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 |
| B、利用油脂在碱性条件下水解,可以生产甘油和肥皂 |
| C、脂肪是有机体组织里储存能量的重要物质 |
| D、植物油通过氢化,即与氢气发生加成反应可以制造植物奶油(人造奶油) |
已知X为碱金属元素,Y为ⅦA族元素,则X与Y形成的化合物中存在的相互作用是( )
| A、分子间作用力 |
| B、极性共价键 |
| C、非极性共价键 |
| D、离子键 |