题目内容
8.航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )| A. | 肼(N2H4)分子中只存在极性共价键 | |
| B. | 该反应中肼作还原剂 | |
| C. | 该反应的反应物总能量高于生成物的总能量 | |
| D. | 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
分析 A.从肼的分子结构分析;
B.根据反应中肼的分子中化合价的变化分析;
C.反应放热说明反应物能量高;
D.根据燃烧热的定义和1g液态肼燃烧放出的热量计算.
解答 解:A.肼中存在N-H极必键,也有N-N非极性键,结构简式为 ,故A错误;
,故A错误;
B.N2H4中N元素为-2价,反应后生成N2为0价,所以N元素化合价升高,所以肼作还原剂,故B正确;
C.反应放热,所以反应物的总能量高于生成物的总能量,故C正确;
D.1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,则1mol肼反应放出的热量为32×20.05=641.60(kJ),故D正确;
故选:A.
点评 本题将热化学方程式的知识、氧化还原、化学键、放热反应等基础知识结合起来,综合性较强.

练习册系列答案
相关题目
19.某浓度的硝酸与镁反应生成Mg(NO3)2、N2O和NH4NO3,若生成N2O 0.02mol和NH4NO30.01mol时恰好完全反应.现用1mol/L的氢氧化钠与上述溶液反应,到沉淀达最大值时加入的氢氧化钠溶液的体积至少应该是( )
| A. | 220mL | B. | 240mL | C. | 260mL | D. | 280mL |
16.为了提纯下列物质(括号内为杂质 有关除杂试剂和分离方法的选择均正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 乙醇(乙酸) | NaOH溶液 | 分液 |
| C | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
3.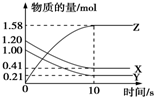 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol•L-1•s-1 | |
| C. | 10 s后,该反应停止进行 | |
| D. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) |
20.在氯化钠的晶体中,下列叙述中,不正确的是( )
| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
17.某细菌中的水解产物A的结构简式如下,下列有关该有机物的叙述正确的是( )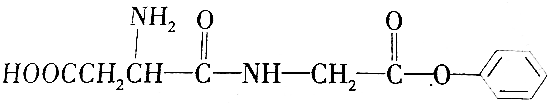
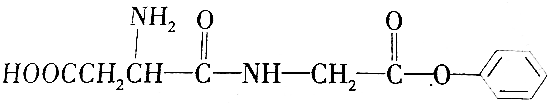
| A. | A的分子式为C12H15O5N2 | |
| B. | 通常用酒精梢灭该细菌,其原理是酒精使细菌中的蛋白质水解而失去生理活性 | |
| C. | A的水解产物中一定含有醇类 | |
| D. | 1 mol A最多可以与1 L 4mol•L-1的Na0H溶液完全反应 |
13.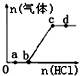 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Ca2+、SO42-、NO3- | |
| B. | b点对应的溶液中:K+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
 →
→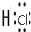 .
. 或
或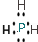 .
.