题目内容
20.在氯化钠的晶体中,下列叙述中,不正确的是( )| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
分析 A.离子化合物中,阴阳离子之间有强烈的吸引作用,也存在排斥力;
B.离子化合物没有分子,只有离子;
C.氯化钠晶体中钠离子或氯离子的配位数都是6;
D.根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,有12个.
解答 解:A.离子键是相邻的阴阳离子之间的强烈的相互作用,不仅包含吸引力还包含排斥力,所以钠离子与氯离子之间存在互相吸引又互相排斥的相互作用,故A正确;
B.氯化钠有钠离子和氯离子构成,没有分子,故B正确;
C.在氯化钠晶体中,如图 假设体心上的是氯离子,则每个氯离子周围都紧邻钠离子位于六个面的面心上,有6个,故C正确;
假设体心上的是氯离子,则每个氯离子周围都紧邻钠离子位于六个面的面心上,有6个,故C正确;
D.根据晶胞的结构 ,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,形成12个面,所以面对角线上的钠离子就有12个,故D错误;
,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,形成12个面,所以面对角线上的钠离子就有12个,故D错误;
故选D.
点评 本题主要考查氯化钠的晶体结构,解题的关键是要熟记常见类型晶胞的结构,本题难度不大.

练习册系列答案
相关题目
10.下列物质熔化时,化学键未被破坏的是( )
| A. | 苏打 | B. | 食盐 | C. | 干冰 | D. | 金刚石 |
8.航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
| A. | 肼(N2H4)分子中只存在极性共价键 | |
| B. | 该反应中肼作还原剂 | |
| C. | 该反应的反应物总能量高于生成物的总能量 | |
| D. | 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
15.用下列装置图进行相应的实验,其中正确的是( )
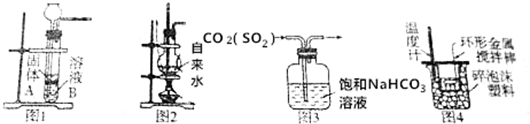

| A. | 用图1装置,若A为石灰石,B为稀硫酸,则可制取二氧化碳 | |
| B. | 用图2装置,若加上冷凝装置,可制取蒸馏水 | |
| C. | 用图3装置,可除去二氧化碳中的杂质二氧化硫 | |
| D. | 用图4装置,可测定中和热 |
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1的溶液中:Na+、K+、SiO32-、SO32- | |
| B. | pH=1的溶液中:K+、Al3+、SO42-、F- | |
| C. | 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2- |
12.我们的一切生命活动过程都与蛋白质有关,没有蛋白质就没有生命,下列有关说法正确的是( )
| A. | 生鸡蛋煮熟后,蛋白质发生变性,人食用后,酶不能发挥作用将蛋白质消化,因此生吃鸡蛋比熟吃好 | |
| B. | 登高山时防晒护目是为了防止紫外线引起皮肤和眼睛蛋白质被烧伤变性 | |
| C. | 温度越高,酶对某些化学反应的催化效率越高 | |
| D. | 毛巾、口罩经常用开水蒸煮,被褥放在太阳光下直射,其目的是使油脂水解 |
4.下列关于海水综合利用的叙述不正确的是( )
| A. | 利用空气吹出SO2吸收法从海水中提溴时,直接将海水氯化,然后再进行吹出、吸收可得到溴产品 | |
| B. | 从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质 | |
| C. | 盐田法制盐时,所用的盐田一般分成贮水池、蒸发池、结晶池三部分 | |
| D. | 利用电渗析法,冷冻法制盐,同时也可以得到淡水 |
5.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z元素均表现最低化合价时的氢化物中,沸点由高到低的排列次序为(写化学式)H2O>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为(写化学式)[Co (NH3)4Cl2]+.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2=N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z元素均表现最低化合价时的氢化物中,沸点由高到低的排列次序为(写化学式)H2O>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为(写化学式)[Co (NH3)4Cl2]+.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2=N2+6H2O.