题目内容
16.下列基态原子的电子排布式或价电子排布式中,正确的是( )| A. | Ca:1s22s22p63s23p63d2 | B. | Cu:3d94s2 | ||
| C. | Fe:3d64s2 | D. | C:1s22s12p3 |
分析 核外电子排布时要遵循能量最低原理、洪特规则、保里不相容原理,电子能量大小顺序是1s<2s<2p<3s<3p<4s<3d等,原子轨道中电子处于全满、全空、半满时最稳定,根据构造原理来分析解答.
解答 解:A.根据能量最低原理知,应该先排4s电子后排3d电子,则Ca基态原子的电子排布为1s22s22p63s23p64s2,故A错误;
B.当原子轨道中电子处于全满、半满或全空时最稳定,则Cu的价电子排布为3d104s1,故B错误;
C.根据能量最低原理知,应该先排4s电子后排3d电子,则Fe原子的价电子排布为3d64s2,故C正确;
D.根据能量最低原理知,应该先排2s电子后排2p电子,则C基态原子的电子排布为1s22s22p2,故D错误;
故选C.
点评 本题考查了原子核外价电子排布式,根据能量最低原理、洪特规则、保里不相容原理等知识点来分析解答,注意结合交错现象分析,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
6.NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述中不正确的是( )
| A. | 降低压强能加快化学反应速率 | |
| B. | 使用适当催化剂可以加快化学反应速率 | |
| C. | 升高温度能加快化学反应速率 | |
| D. | 增大压强可以加快此反应的速率 |
4.下列说法正确的是( )
| A. | 淀粉、纤维素等高分子化合物均属于纯净物 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 丁达尔效应可用于区别溶液与胶体 |
1.某基态原子R的价电子构型为ns2np1,下列判断错误的是( )
| A. | 属于电负性很大的元素 | B. | 属于第n周期元素 | ||
| C. | 属于第ⅢA(主族)元素 | D. | 属于p区元素 |
5.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,16g CH4中含有的原子总数为5NA | |
| B. | 78g苯含有碳碳双键的数目为3NA | |
| C. | 1mol/L NaCl溶液中含有的氯离子数目为NA | |
| D. | 标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA |
6.下列四个图象中,反映出的对应变化关系错误的是( )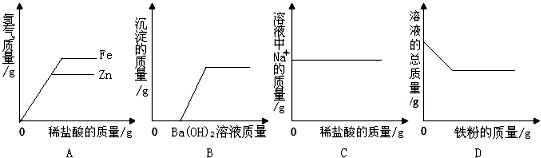

| A. | 将等质量的锌片和铁片分别加入足量的等质量等质量分数的稀盐酸中 | |
| B. | 向盐酸与硫酸钠混合溶液中加入氢氧化钡溶液 | |
| C. | 向一定量的氢氧化钠溶液中滴加稀盐酸 | |
| D. | 向一定量的硫酸铜溶液中加入铁粉 |