题目内容
1.某基态原子R的价电子构型为ns2np1,下列判断错误的是( )| A. | 属于电负性很大的元素 | B. | 属于第n周期元素 | ||
| C. | 属于第ⅢA(主族)元素 | D. | 属于p区元素 |
分析 根据核外电子排布确定原子结构特点,可确定元素在周期表中的位置;ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,据此进行解答.
解答 解:某基态原子R的价电子构型为ns2np1,该元素位于元素周期表中ⅢA族,
A.非金属性越强,电负性越强,ⅤⅡA族元素的电负性较强,所以ⅢA族元素的电负性不强,故A错误;
B.根据价电子构型ns2np1可知,R含有n个电子层,位于第n周期,故B正确;
C.R最外层含有3个电子,位于周期表中ⅢA族,故C正确;
D.R元素最后填充的为p电子,属于p区元素,故D正确;
故选A.
点评 本题考查原子核外电子的排布,题目难度中等,明确原子结构与元素周期表的关系为解答关键,注意掌握原子核外电子的排布规律,试题培养了学生的灵活应用能力.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
12.把下列四种 X 溶液,分别加入四个盛有 10mL 2mol/L 盐酸的烧杯中,均加水稀释到 50mL,此时 X 与盐酸和缓地进行反应.其中反应速率最大的是( )
| A. | 20mL3mol/L 的 X 溶液 | B. | 20mL2mol/L 的 X 溶液 | ||
| C. | 10mL4mol/L 的 X 溶液 | D. | 10mL2mol/L 的 X 溶液 |
9.(1)用正确的序号填空:①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是①; 互为同素异形体的是②;
互为同分异构体的是④; 互为同系物的是⑤
(2)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
互为同位素的是①; 互为同素异形体的是②;
互为同分异构体的是④; 互为同系物的是⑤
(2)由A、B、C、D四种金属按下表中装置进行实验.
| 装置 |  |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
16.下列基态原子的电子排布式或价电子排布式中,正确的是( )
| A. | Ca:1s22s22p63s23p63d2 | B. | Cu:3d94s2 | ||
| C. | Fe:3d64s2 | D. | C:1s22s12p3 |
6.从下列元素中:H、O、N、Si、S、Mg选出其中的一种或几种,组成典型的四类晶体,要求:每种元素只能出现一次;所填物质必须能够回答问题(2)和(3):
(1)填充下表:
(2)构成晶体B的基态原子的电子排布式为1s22s22p63s23p2,
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
(1)填充下表:
| 物质代号 | A | B | C | D |
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 相应的化学式 |
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
11.细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺.它主要是应用细菌法溶浸贫矿、废矿、尾矿等,以回收某些贵重有色金属和稀有金属,达到防止矿产资源流失,最大限度地利用矿藏.下列有关细菌冶金的说法中不正确的是( )
| A. | 细菌冶金能充分利用资源和废物,能耗低 | |
| B. | 细菌冶金不产生二氧化硫等有毒气体,环境污染少 | |
| C. | 细菌冶金温度越高,化学反应速率越快,采矿效率越高 | |
| D. | 推广细菌冶金体现了绿色化学理念,有利于经济可持续发展 |
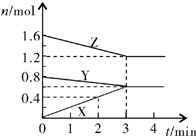 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: