题目内容
16.下表是元素周期表的一部分,表中的每个字母代表一种短周期元素.| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
(2)e元素位于第三周期第ⅠA族,它的元素符号是Na;
(3)c元素原子的最外层电子数为5;
(4)b、c、d三种元素的非金属性逐渐增强(填“减弱”或“增强”);
(5)f的元素符号为S.
分析 由元素在周期表的位置可知,a为H,b为C,c为N,d为O,r为Na,f为S.
(1)a元素和b元素可以形成最简单的有机物为甲烷;
(2)e为钠元素;
(3)c为N,最外层电子数等于族序数;
(4)b、c、d三种元素位于同周期,从左向右非金属性增强;
(5)f为硫元素.
解答 解:由元素在周期表的位置可知,a为H,b为C,c为N,d为O,r为Na,f为S.
(1)a元素和b元素可以形成最简单的有机物为甲烷,化学式为CH4,故答案为:CH4;
(2)e为钠元素,元素符号为Na,故答案为:Na;
(3)c为N,最外层电子数等于族序数,最外层电子数为5,故答案为:5;
(4)b、c、d三种元素位于同周期,从左向右非金属性增强,则b、c、d三种元素的非金属性逐渐增强,故答案为:增强;
(5)f为硫元素,元素符号为S,故答案为:S.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素周期律为解答的关键,注意原子结构与位置的关系,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Mg2+、Na+、SO42-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Na+、K+、OH-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
4. 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
| A. | 在400℃时,反应①未达平衡,反应②达到平衡 | |
| B. | 800℃后再升高温度,反应①的平衡逆向移动;反应②的平衡正向移动 | |
| C. | 加压可提高NH3生成NO的转化率 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=-181.5 kJ•mol-1 |
11.下列说法正确的是( )
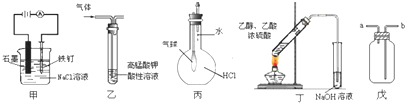
①装置甲可以防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可以验证HCl在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、HCl、NO2等气体.

①装置甲可以防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可以验证HCl在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、HCl、NO2等气体.
| A. | ①⑤ | B. | ②③ | C. | ③⑤ | D. | ④⑤ |
1.根据下图所给信息,得出的结论正确的是( )


| A. | 碳的燃烧热为b kJ/mol | B. | 2C(s)+O2(g)═2CO(g)△H=-2(b-a) kJ/mol | ||
| C. | 2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol | D. | C(s)+O2(g)═CO2(g)△H<-b kJ/mol |
5.下列能达到实验目的是( )


| A. | 图①用于除Cl2中混有的HCl气体 | |
| B. | 图②可用于制取并收集少量NO2气体 | |
| C. | 图③所示实验装置可用排空气法收集CO2 | |
| D. | 图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
6.实验室用已知密度的37%的盐酸配制15%的盐酸,除量筒、烧杯外还需使用下列仪器中的( )
| A. | 托盘天平 | B. | 容量瓶 | C. | 玻璃棒 | D. | 胶头滴管 |

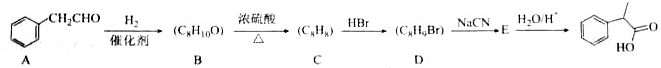
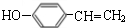 .
.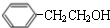 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$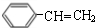 +H2O;C→D的反应类型为加成反应
+H2O;C→D的反应类型为加成反应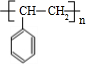 .
. 某位同学在查阅资料时发现含氮化合物有以下性质:
某位同学在查阅资料时发现含氮化合物有以下性质: