题目内容
3.已知:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol.某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是( )| A. | 5min内用O2表示的反应速率为0.12mol/(L•min) | |
| B. | 加入催化剂,可使该反应的化学反应速率加快,△H变小 | |
| C. | SO2的平衡浓度为0.12mol/L | |
| D. | 达到平衡时,若增大容器的体积,则该反应的化学反应速率减慢 |
分析 5min后达到平衡,共放出热量11.76kJ,可知生成SO3为$\frac{11.76kJ}{196kJ/mol}$=0.06mol,则
2SO2(g)+O2(g)?2SO3(g)
开始 0.2 0.1 0
转化 0.06 0.03 0.06
平衡 0.14 0.07 0.06
A.结合v=$\frac{△c}{△t}$计算;
B.催化剂加快反应速率,不影响焓变;
C.结合c=$\frac{n}{V}$计算;
D.达到平衡时,若增大容器的体积,压强减小.
解答 解:5min后达到平衡,共放出热量11.76kJ,可知生成SO3为$\frac{11.76kJ}{196kJ/mol}$=0.06mol,则
2SO2(g)+O2(g)?2SO3(g)
开始 0.2 0.1 0
转化 0.06 0.03 0.06
平衡 0.14 0.07 0.06
A.5min内用O2表示的反应速率为$\frac{\frac{0.03mol}{2L}}{5min}$=0.003mol/(L•min),故A错误;
B.加入催化剂,可使该反应的化学反应速率加快,△H不变,故B错误;
C.SO2的平衡浓度为$\frac{0.14mol}{2L}$=0.07mol/L,故C错误;
D.达到平衡时,若增大容器的体积,压强减小,则该反应的化学反应速率减慢,故D正确;
故选D.
点评 本题考查化学平衡的计算及平衡移动,为高频考点,把握能量变化与物质的量的关系、化学平衡三段法为解答的关键,侧重分析与计算能力的考查,注意判断转化的物质的量,题目难度不大.

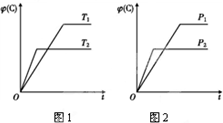 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡后,若使用催化剂,C的体积分数将增大 | |
| B. | 平衡后,若温度升高,化学平衡向正反应方向移动 | |
| C. | 平衡后,增加A的质量化学平衡向正反应方向移动 | |
| D. | 化学方程式中,化学计量数的关系为n<e+f |
| A. | 2:3 | B. | 2:1 | C. | 1:1 | D. | 4:3 |
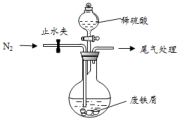 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
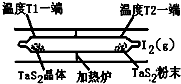 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.