题目内容
下列有关元素周期表的叙述不正确的是( )
| A、原子半径最小的是H |
| B、第n周期第n主族的元素均为金属 |
| C、金属元素的种类多于非金属元素 |
| D、所含元素单质在常温下状态最多的是第ⅦA族 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A、原子半径最小的是电子层数最少,第一周期的氢;
B、第一周氢就不符合;
C、副族元素中没有非金属元素,元素周期表中金属元素的种类比非金属元素多;
D、第ⅦA族元素单质在常温下涉及气态、固态、液态.
B、第一周氢就不符合;
C、副族元素中没有非金属元素,元素周期表中金属元素的种类比非金属元素多;
D、第ⅦA族元素单质在常温下涉及气态、固态、液态.
解答:
解:A、原子半径最小的是电子层数最少,第一周期的氢,故A正确;
B、第一周氢就不符合,故B错误;
C、副族元素中没有非金属元素,元素周期表中金属元素的种类比非金属元素多,故C正确;
D、第ⅦA族元素单质在常温下涉及气态、固态、液态,故D正确;
故选B.
B、第一周氢就不符合,故B错误;
C、副族元素中没有非金属元素,元素周期表中金属元素的种类比非金属元素多,故C正确;
D、第ⅦA族元素单质在常温下涉及气态、固态、液态,故D正确;
故选B.
点评:本题考查元素周期表的结构及应用,为高频考点,把握元素的性质及原子结构与元素位置的关系、元素周期律为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列各项表达中正确的是( )
A、Na2O2的电子式为 |
| B、二氧化硅的分子式为SiO2 |
C、氦原子的电子排布图为  |
D、Cl-的结构示意图为 |
容量瓶上未必有固定的( )
| A、溶液浓度 | B、容量 |
| C、定容刻度 | D、配制温度 |
下列说法正确的是( )
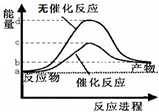

| A、根据如图知该反应有催化剂和无催化剂的活化能相差d-c,但其反应热均为a-b | ||
| B、若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5kJ/mol | ||
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | ||
| D、已知:Ⅰ:对于反应:3Si(s)+2N2(g)=Si3N4(s)△H=-a kJ/mol,Ⅱ:N≡N键能为bkJ?mol-1Si-Si键能为ckJ?mol-1 且a、b、c均大于零,则断开1 mol Si-N键所需的能量为
|
四氟乙烯(CF2=CF2)可以看作是乙烯分子中的所有氢原子被氟原子取代,它和乙烯性质相似.聚四氟乙烯可做家用不粘锅的内衬.下列说法正确的是( )
| A、四氟乙烯不能使溴水褪色 |
| B、四氟乙烯分子中所有原子在同一平面 |
| C、聚四氟乙烯的性质活泼,易燃易爆 |
| D、聚四氟乙烯可由乙烯和氟气(F2)加成制得 |
下列关于化学键的叙述不正确的是( )
| A、离子化合物一定含有离子键 |
| B、共价键只存在于共价化合物中 |
| C、化学键的形成与成键原子结构有关,主要通过原子之间价电子的得失或共用来实现 |
| D、化学反应的本质是旧键断裂,新键形成 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、135gC1O2中含有的分子数为2NA |
| B、标准状况时,22.4L水中含氧原子数为NA |
| C、1mol氦气所含原子个数为2NA |
| D、在25℃,101KPa下,2gH2所含质子个数为NA |
下列关于Si、C、S、Cl四种元素的说法中,正确的是( )
| A、在自然界中都能以游离态存在 |
| B、两两结合形成的化合物都是共价化合物 |
| C、氢化物的热稳定性比较:CH4>SiH4>H2S>HCl |
| D、最高价氧化物都能与水反应生成相应的酸,且酸性依次增强 |
