题目内容
15.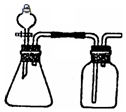 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
| A. | ①⑤⑥ | B. | ①③⑥ | C. | ①②⑤ | D. | ③⑤⑥ |
分析 由反应装置可知,制取的气体不需要加热,为固体与液体反应的简易实验装置,且气体的密度比空气密度大、不与空气充分反应,以此来解答.
解答 解:①亚硫酸钠和浓硫酸在常温下反应生成二氧化硫,二氧化硫密度比空气大,可用向上排空气收集,故正确;
②铝和烧碱溶液生成氢气,但氢气的密度比空气小,不能用向上排空气收集,故错误;
③铜和稀硝酸反应生成NO,NO与氧气反应,不能用排空法收集,故错误;
④铜和浓硫酸需要在加热的条件下进行,故错误;
⑤双氧水和二氧化锰不需要加热,反应生成氧气的密度大于空气,图示装置满足该反应条件,故⑤正确;
⑥铜和浓硝酸在常温下反应生成二氧化氮,二氧化氮密度比空气大,可用向上排空气收集,故正确.
故选A.
点评 本题考查实验装置的综合应用,为高频考点,侧重常见气体的制备实验原理及收集方法的考查,注意气体的性质与收集方法的关系,题目难度不大.

练习册系列答案
相关题目
12.亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用作食品防腐剂和肉类食品的发色剂.已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2═2NaI+I2+2NO↑+2H2O.下列说法错误的是( )
| A. | 人误食亚硝酸钠中毒时,不可以服用氢碘酸解毒 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2 | |
| D. | 当有2molHI被氧化时,转移电子数是2NA(设NA为阿伏加德罗常数的值) |
6. 如图为氢氧燃料电池构造示意图,已知其电极反应分别为:
如图为氢氧燃料电池构造示意图,已知其电极反应分别为:
2H2+4OH--4e═4H2O,O2+2H2O+4e-═4OH-,
则( )
 如图为氢氧燃料电池构造示意图,已知其电极反应分别为:
如图为氢氧燃料电池构造示意图,已知其电极反应分别为:2H2+4OH--4e═4H2O,O2+2H2O+4e-═4OH-,
则( )
| A. | H2入口处为正极,发生氧化反应 | B. | H2入口处为正极,发生还原反应 | ||
| C. | H2入口处为负极,发生氧化反应 | D. | H2入口处为负极,发生还原反应 |
3.在反应:C+CO2═2CO中,不能使反应速率增大的是( )
| A. | 增加碳的量 | B. | 升高温度 | C. | 通入CO2 | D. | 用碳粉代替焦炭 |
10.向一恒容密闭容器中充入1mol N2和3mol H2,在一定条件下反应.下列叙述中,能说明上述反应达到化学平衡状态的是( )
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 混合气体的总物质的量不随时间的变化而变化 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 单位时间内每消耗3mol H2,同时生成2mol NH3 |
20. 如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )
如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )
 如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )
如图所示装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )| A. | a是Ag、b是Fe、c为AgNO3溶液 | B. | a是Fe、b是Ag、c为AgNO3溶液 | ||
| C. | a是Zn、b是Cu、c为稀H2SO4 | D. | a是Cu、b是Zn、c为稀H2SO4 |
7.化学与生活密切相关.下列说法错误的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| B. | 铜盐溶液都有毒,这主要是由于铜离子能使蛋白质变性 | |
| C. | 通常所说的三大有机合成材料为:塑料、合成橡胶、合成纤维 | |
| D. | 酸雨被称为“天堂的眼泪”,某雨水样品放置一段时间后,pH由4.68变为4.00,是因为水中溶解的CO2增多 |
2.在20℃时,某气态烃与氧气混合,装入密闭容器中,点燃爆炸后,又恢复到20℃,此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎成真空,此烃的分子式可能是( )
| A. | CH4 | B. | C2H4 | C. | C4H8 | D. | C7H16 |
3.将铜片与浓硫酸共热的气体通入少量下述溶液,一定不会得到无色澄清溶液的是( )
| A. | 稀品红溶液 | B. | 滴加过氧化氢溶液的BaCl2溶液 | ||
| C. | Ba(OH)2溶液 | D. | 溴水 |