题目内容
3.将铜片与浓硫酸共热的气体通入少量下述溶液,一定不会得到无色澄清溶液的是( )| A. | 稀品红溶液 | B. | 滴加过氧化氢溶液的BaCl2溶液 | ||
| C. | Ba(OH)2溶液 | D. | 溴水 |
分析 铜片与浓硫酸共热的气体为二氧化硫,具有漂白性、还原性和氧化性,以此来解答.
解答 解:A.二氧化硫具有漂白性,可使品红褪色,故A不选;
B.二氧化硫与过氧化氢反应生成硫酸,再与氯化钡反应生成硫酸钡白色沉淀,故B选;
C.二氧化硫足量,与Ba(OH)2反应生成亚硫酸氢钡溶液,故C不选;
D.二氧化硫与溴水发生氧化还原反应生成硫酸、HBr,溶液为无色,故D不选;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.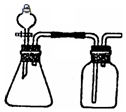 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
| A. | ①⑤⑥ | B. | ①③⑥ | C. | ①②⑤ | D. | ③⑤⑥ |
14.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3 <H2SO4,判断硫与碳的非金属性强弱 | |
| D. | F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱 |
11.19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
| A. | 提出了原子学说 | B. | 提出了元素周期律 | ||
| C. | 提出了相对论 | D. | 制定了第一张元素周期表 |
18.下列说法正确的是( )
| A. | 所有共价键都有方向性 | |
| B. | s轨道和p轨道重叠可以形成π键 | |
| C. | 若把H2S分子写成H3S分子,违背了共价键的饱和性 | |
| D. | 两个原子之间形成共价键时,可形成多个σ键 |
15.将5.88g某磁铁矿样品(含Fe、O、Si、H四种元素)投入足量盐酸中充分反应,过滤,向滤液中加入过量NaOH溶液,充分反应后过滤、洗涤、灼烧得固体3.6g,则矿样中Fe3O4的含量约是( )
| A. | 54.8% | B. | 59.2% | C. | 61.8% | D. | 76.5% |
12.下列过程不属于化学变化的是( )
| A. | 从铜矿中冶炼铜 | B. | 从铝矿中炼铝 | ||
| C. | 从海水中冶炼钠 | D. | 从铁矿中开采铁矿石 |
12.下列各组气体均可在如图装置中发生喷泉实验的是( )
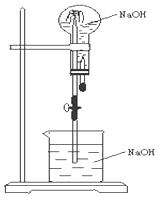

| A. | HCl和CO2 | B. | NH3 和CH4 | C. | SO2 和CO | D. | NO和NO2 |
