题目内容
印刷电路板上使用的铜需要回收利用
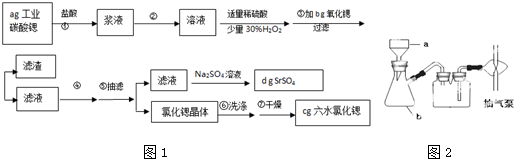
I.方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2?2H2O,实验室模拟回收过程如下:

①证明步骤1所加FeCl3溶液过量的方法是 .
②步骤2中所加的氧化剂最适宜的是 .
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 .(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经 得到CuCl2?2H2O.
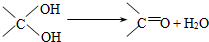
方法二:用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)═2H2O(l)+O2(g)△H2=-196kJ/mol
H2(g)+
O2(g)═H2O(l)△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H= .
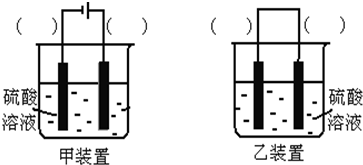
II.欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).
I.方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2?2H2O,实验室模拟回收过程如下:

①证明步骤1所加FeCl3溶液过量的方法是
②步骤2中所加的氧化剂最适宜的是
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
方法二:用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)═2H2O(l)+O2(g)△H2=-196kJ/mol
H2(g)+
| 1 |
| 2 |
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H=
II.欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).

考点:物质分离和提纯的方法和基本操作综合应用,热化学方程式,原电池和电解池的工作原理
专题:基本概念与基本理论
分析:I.FeCl3溶液浸泡印刷电路板时三价铁氧化铜生成二价铁和二价铜离子,加氧化剂将二价铁氧化成三价铁,再加氧化铜或氢氧化铜调节PH值使铁以氢氧化铁沉淀而除去,过滤得到滤液只含氯化铜溶液,再加入浓盐酸,抑制水解,再经过蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O,以此分析解答;
方法一:①根据检验三价铁离子的方法;
②根据根据除去二价铁离子的过程中不能引入新的杂质;
③根据pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质;
④CuCl2在溶液中可以发生水解反应,加入浓盐酸,可以抑制水解;
方法二:根据盖斯定律来计算;
II.Cu和H2SO4之间的反应是非自发的,需要电解池实现,根据电解池的构成条件来回答.
方法一:①根据检验三价铁离子的方法;
②根据根据除去二价铁离子的过程中不能引入新的杂质;
③根据pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质;
④CuCl2在溶液中可以发生水解反应,加入浓盐酸,可以抑制水解;
方法二:根据盖斯定律来计算;
II.Cu和H2SO4之间的反应是非自发的,需要电解池实现,根据电解池的构成条件来回答.
解答:
解:I.FeCl3溶液浸泡印刷电路板时三价铁氧化铜生成二价铁和二价铜离子,加氧化剂将二价铁氧化成三价铁,再加氧化铜或氢氧化铜调节PH值使铁以氢氧化铁沉淀而除去,过滤得到滤液只含氯化铜溶液,再加入浓盐酸,抑制水解,再经过蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O;
方法一:①检验三价铁离子的方法:取少量待检液于试管中,滴加KSCN溶液,溶液变为红色,故答案为:取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量;
②HNO3、H2O2C、KMnO4三者都能氧化二价铁离子变成三价铁离子,但HNO3和KMnO4会引入新的杂质,故选:B;
③pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质,可向溶液中加入CuO或Cu(OH)2,故答案为:CuO或Cu(OH)2;
④CuCl2在溶液中可以发生水解反应,加入浓盐酸,可以抑制水解,再经过蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O,
故答案为:CuCl2在溶液中可以发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解;冷却结晶、过滤;
方法二:Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol ①
2H2O2(l)═2H2O(l)+O2(g)△H2=-196kJ/mol ②
H2(g)+
O2(g)═H2O(l)△H3=-286kJ/mol ③
利用盖斯定律,将①-
×②-③可得:Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)△H=+64kJ/mol,故答案为:+64kJ/mol;
II.Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即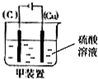 ,
,
故答案为: .
.
方法一:①检验三价铁离子的方法:取少量待检液于试管中,滴加KSCN溶液,溶液变为红色,故答案为:取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量;
②HNO3、H2O2C、KMnO4三者都能氧化二价铁离子变成三价铁离子,但HNO3和KMnO4会引入新的杂质,故选:B;
③pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质,可向溶液中加入CuO或Cu(OH)2,故答案为:CuO或Cu(OH)2;
④CuCl2在溶液中可以发生水解反应,加入浓盐酸,可以抑制水解,再经过蒸发浓缩、冷却结晶、过滤得到CuCl2?2H2O,
故答案为:CuCl2在溶液中可以发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解;冷却结晶、过滤;
方法二:Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol ①
2H2O2(l)═2H2O(l)+O2(g)△H2=-196kJ/mol ②
H2(g)+
| 1 |
| 2 |
利用盖斯定律,将①-
| 1 |
| 2 |
II.Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即
 ,
,故答案为:
 .
.
点评:本题考查金属的回收,涉及到氧化还原反应、热盖斯定律的应用、电解池的工作原理,难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
胶体区别于其他分散系的本质特征是( )
| A、胶体带电,有电泳的性质 |
| B、不能透过半透膜 |
| C、分散质粒子直径在1nm~100nm之间 |
| D、布朗运动 |
在由水电离的c(H+)=10-14 mol?L-1的溶液中,一定能大量共存的离子组是( )
| A、K+、Fe2+、SO42-、Mg2+ |
| B、Na+、Cl-、NH4+、S2- |
| C、Al3+、Na+、Cl-、S2- |
| D、Na+、K+、Br-、Cl- |
下列说法正确的是( )
| A、电子层结构相同的微粒,其化学性质一定相似 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D、元素周期律是元素原子核外电子排布周期性变化的结果 |