题目内容
15. 化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )| A. | 1 mol X在一定条件下最多与8 mol H2加成 | |
| B. | 1 mol X在一定条件下最多能与2 mol NaOH反应 | |
| C. | X中有二种含氧官能团,酸性条件下水解产物中也有二种含氧官能团 | |
| D. | X分子式为C16H12O4,和乙醇发生反应生成分子式为C18H18O5的酯 |
分析 由结构可知分子式,分子中含-COOH、-COOC-,结合羧酸、酯的性质来解答.
解答 解:A.能与氢气反应的官能团为苯环,则1 mol X在一定条件下最多与6 mol H2加成,故A错误;
B.含-COOH、-COOC-,均与NaOH反应,且水解生成的酚-OH与NaOH反应,则1 mol化合物X最多能与3 mol NaOH反应,故B错误;
C.含-COOH、-COOC-,水解可生成-OHH、-COOH,故C正确;
D.X的分子式为C16H12O4,和乙醇发生反应生成分子式为C18H16O5的酯,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5. (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(2)某研究性学习小组用pH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的pH值(选用酚酞作为指示剂)
①实验过程中需要使用的仪器有铁架台、滴定管夹、碱式滴定管、胶头滴管、酸式滴定管、锥形瓶
②如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
③如何判断滴定到达终点当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色
④根据下列数据:
请计算待测NaOH溶液的浓度(保留两位小数)0.0800 mol/L
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:BD.
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.酸式滴定管尖嘴部分有气泡,滴定后消失.
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.(2)某研究性学习小组用pH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的pH值(选用酚酞作为指示剂)
①实验过程中需要使用的仪器有铁架台、滴定管夹、碱式滴定管、胶头滴管、酸式滴定管、锥形瓶
②如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
③如何判断滴定到达终点当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色
④根据下列数据:
| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:BD.
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.酸式滴定管尖嘴部分有气泡,滴定后消失.
6.下列关于苯的叙述正确的是( )
| A. | 不能和氢气反应 | B. | 属于不饱和烃 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 含有碳碳双键 |
3.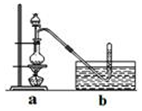 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)$→_{△}^{ZnCl_{2}}$ CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是在干燥的HCl气氛中加热
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是增大盐酸的量以提高甲醇的转化率.
(3)实验室为何用排水法收集CH3Cl?CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂:
A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶BAC (填洗气瓶编号),如果观察到A紫色褪去 则证实上述资料的正确性.
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+H+
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛乙醇 的洗气瓶.
(4)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
第一次实验数据出现异常,造成这种异常的原因可能是bd (填字母代号).
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)$→_{△}^{ZnCl_{2}}$ CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是在干燥的HCl气氛中加热
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是增大盐酸的量以提高甲醇的转化率.
(3)实验室为何用排水法收集CH3Cl?CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂:
A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶BAC (填洗气瓶编号),如果观察到A紫色褪去 则证实上述资料的正确性.
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+H+
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛乙醇 的洗气瓶.
(4)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
10.常温下,甲酸、乙酸电离常数:Ka(HCOOH)=1.77x10-4、Ka(CH3COOH)=1.75×10-5有甲、乙、丙三种溶液:
下列叙述错误的是( )
| 甲 | 1000mL 0.1mol/L HCOONa溶液 |
| 乙 | 1000mL 0.1mol/L CH3COONa溶液 |
| 丙 | 1000mL含HCOONa、CH3COONa各0.05mol的溶液 |
| A. | 溶液中c(Na+):甲=乙>丙 | |
| B. | 溶液中阴、阳离子和酸分子总数:甲<丙<乙 | |
| C. | 溶液pH:甲<丙<乙 | |
| D. | 溶液中阴、阳离子总数:甲>丙>乙 |
4.图中没有涉及到的能量转化形式是( )


| A. | 化学能转化为热能 | B. | 太阳能转化为化学能 | ||
| C. | 势能转化为电能 | D. | 化学能转化为势能 |
5.表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为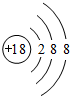 .
.
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是S>Cl>F(用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑤与元素⑧形成的化合物的电子式为 .
.
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是镁 (填名称),可以验证该结论的实验是BC(填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.(2)元素③、⑦、⑧中,原子半径从大到小的顺序是S>Cl>F(用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑤与元素⑧形成的化合物的电子式为
 .
.(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是镁 (填名称),可以验证该结论的实验是BC(填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
 如图为原电池装置示意图:
如图为原电池装置示意图: