题目内容
乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.

完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是 .
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是 (填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是 .(选填编号)
a.溴水褪色b.有油状物质生成
c.反应后水溶液酸性增强d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是 .(选填编号)
a.甲装置乙酸转化率高
b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施
d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3
以上流程中试剂A的化学式是 ;操作Ⅱ的名称是 ;操作Ⅲ一般适用于分离 混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入 ,产物可变为无色.与方案①相比较,方案②的明显缺点是 .

完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是
a.溴水褪色b.有油状物质生成
c.反应后水溶液酸性增强d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是
| 物质 | 沸点(℃) |
| 乙醇 | 78.5 |
| 乙酸 | 117.9 |
| 乙酸乙酯 | 77 |
b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施
d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3
以上流程中试剂A的化学式是
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入
考点:乙烯的实验室制法,乙酸乙酯的制取,溴乙烷的制取
专题:
分析:(1)乙醇制取乙烯,生成物中含有水,浓硫酸具有吸水性,据此解答即可;
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,据此解答即可;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失,据此解答即可.
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,据此解答即可;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失,据此解答即可.
解答:
解:(1)乙醇制取乙烯,生成物中含有水,浓硫酸具有吸水性,故利用浓硫酸的吸水性,使反应可以向有利于生成乙烯的方向进行,故答案为:利用浓硫酸的吸水性,使反应向有利于生成乙烯的方向进行;
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,故答案为:NaOH;d;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应,乙酸转化率高,故选b、d;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠,根据强酸制弱酸,要用硫酸反应得到乙酸,再蒸馏得到乙酸,蒸馏一般适用于相互溶解但沸点差别较大的液体混合物,
故答案为:Na2CO3;分液;相互溶解但沸点差别较大的液体混合物;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色,溴单质具有氧化性,能与亚硫酸钠反应生成硫酸钠和溴化钠;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失,故答案为:Na2SO3;先加浓硫酸会有较多HBr气体生成,HBr挥发会造成HBr的损耗.
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,故答案为:NaOH;d;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应,乙酸转化率高,故选b、d;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠,根据强酸制弱酸,要用硫酸反应得到乙酸,再蒸馏得到乙酸,蒸馏一般适用于相互溶解但沸点差别较大的液体混合物,
故答案为:Na2CO3;分液;相互溶解但沸点差别较大的液体混合物;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色,溴单质具有氧化性,能与亚硫酸钠反应生成硫酸钠和溴化钠;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失,故答案为:Na2SO3;先加浓硫酸会有较多HBr气体生成,HBr挥发会造成HBr的损耗.
点评:本题主要考查的是实验室中乙烯的制取方法,综合性较强,考查了同学们对实验的综合把握能力,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,下列离子在指定条件下能大量共存的是( )
| A、c(I-)=0.1 mol/L的溶液中:Ca2+、NO3-、Fe3+、Cl- |
| B、SO2饱和溶液中:NH4+、K+、CO32-、ClO- |
| C、放入镁带有气体逸出的溶液中:Na+、K+、Cl-、SO42- |
| D、水电离出c(H+)=1×10-10mol/L溶液中:Cu2+、Na+、S2-、CH3COO- |
下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) |
| B、1mol?L-1CH3COONa溶液与0.5mol?L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) |
| C、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)+c(Fe2+)=0.3mol?L-1 |
| D、物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(NCN) |
某兴奋剂的结构简式如图所示.下列说法不正确的是( )


| A、该物质的分子式为C16H16O3 |
| B、该物质分子内所碳原子有可能在同一平面内 |
| C、该物质可发生加成、取代、氧化等反应 |
| D、该物质可使酸性高锰酸钾溶液和溴水褪色,且原理相同 |
25℃时,在浓度均为1mol/L的溶液中,各组离子一定能大量共存的是( )
| A、盐酸中:K+、Mg2+、Fe2+、MnO4-、 |
| B、NaOH溶液中:Cu2+、NH4+、SO42-、CO32- |
| C、FeCl3溶液中:Al3+、Na+、SCN-、SO42- |
| D、NaClO溶液中:K+、SO42-、OH-、NO3- |

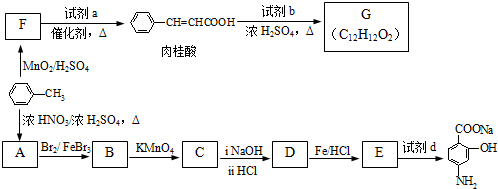
 (R=-CH3或-H)
(R=-CH3或-H)