题目内容
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)= mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10mol?L-1 CH3COOH的电离程度增大的是 .
a.加入少量0.10mol?L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010mol?L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10mol?L-1NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸) V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图1、2所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)

(5)常温下,将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为 .
(6)图3表示溶液中c(H+)和c(OH-)的关系.
①M区域内(阴影部分)任意点c(H+) c(OH-)(填“大于”、“小于”或“等于”).
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液
的体积比为 .(混合后溶液体积的变化忽略不计)
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=
(2)下列方法中可以使0.10mol?L-1 CH3COOH的电离程度增大的是
a.加入少量0.10mol?L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010mol?L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10mol?L-1NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图1、2所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是

(5)常温下,将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为
(6)图3表示溶液中c(H+)和c(OH-)的关系.
①M区域内(阴影部分)任意点c(H+)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液
的体积比为
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)醋酸溶液中氢离子由醋酸和水电离;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(3)生成氢气的体积取决于酸的量的多少;
(4)根据盐酸和醋酸在滴定开始时的pH来判断;
(5)溶液显中性,说明氢离子和氢氧根的浓度一定相等,醋酸钠是强碱弱酸盐,水解显碱性,根据电荷守恒来判断离子浓度大小关系;
(6)①在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-);
②先求出该温度下的Kw,再根据混合为中性,即酸碱恰好反应求出体积比.
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(3)生成氢气的体积取决于酸的量的多少;
(4)根据盐酸和醋酸在滴定开始时的pH来判断;
(5)溶液显中性,说明氢离子和氢氧根的浓度一定相等,醋酸钠是强碱弱酸盐,水解显碱性,根据电荷守恒来判断离子浓度大小关系;
(6)①在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-);
②先求出该温度下的Kw,再根据混合为中性,即酸碱恰好反应求出体积比.
解答:
解:(1)醋酸溶液中氢离子由醋酸和水电离,pH=5醋酸溶液中,水电离的c(OH-)=
=10-9mol?L-1,则水电离的c(H+)=10-9mol?L-1,所以溶液中醋酸电离的c(H+)=10-5-10-9mol?L-1,所以c(CH3COO-)=c(H+)=10-5-10-9mol?L-1,
故答案为:10-5-10-9mol?L-1;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol?L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol?L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol?L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:bcf;
(3)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以等体积且pH均等于3的醋酸和盐酸溶液中,醋酸产生的氢气体积较大,
故答案为:小于;
(4)滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定醋酸的曲线是图2,故答案为:图2;
(5)将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,反应生成醋酸,如等体积混合物,溶液呈酸性,溶液呈中性,应加入少量盐酸,生成醋酸,则c(Na+)>c(CH3COO-)>c(Cl-)溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,c(H+)=c(OH-),则有c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-);
(6)①XZ连线的斜率是1,存在c(H+)=c(OH-),在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-),即M区域内(阴影部分)任意点c(H+)小于c(OH-),故答案为:小于;
②在T2温度下,Kw=c(H+)×c(OH-)=10-6×10-6=10-12,所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-3 mol?L-1=V(HCl)?10-4 mol?L-1,得V(NaOH):V(HCl)=1:10,故答案为:1:10.
| Kw |
| c(H+) |
故答案为:10-5-10-9mol?L-1;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol?L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol?L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol?L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:bcf;
(3)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以等体积且pH均等于3的醋酸和盐酸溶液中,醋酸产生的氢气体积较大,
故答案为:小于;
(4)滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定醋酸的曲线是图2,故答案为:图2;
(5)将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,反应生成醋酸,如等体积混合物,溶液呈酸性,溶液呈中性,应加入少量盐酸,生成醋酸,则c(Na+)>c(CH3COO-)>c(Cl-)溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,c(H+)=c(OH-),则有c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-);
(6)①XZ连线的斜率是1,存在c(H+)=c(OH-),在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-),即M区域内(阴影部分)任意点c(H+)小于c(OH-),故答案为:小于;
②在T2温度下,Kw=c(H+)×c(OH-)=10-6×10-6=10-12,所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-3 mol?L-1=V(HCl)?10-4 mol?L-1,得V(NaOH):V(HCl)=1:10,故答案为:1:10.
点评:本题考查了水的电离、水的离子积及溶液pH的简单计算,影响弱电解质电离平衡的因素等,题目难度中等,解题关键是在搞清楚温度对水电离平衡、水的离子积和溶液pH的影响.

练习册系列答案
相关题目
用Zn片、Cu片和稀硫酸组成的电池装置.下列有关该装置的说法不正确的是( )
| A、该装置将化学能转变为电能 |
| B、溶液中的阳离子向锌电极移动 |
| C、Cu极上有气泡产生,发生还原反应 |
| D、电流方向是从铜片流向锌片 |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 用此图装置制取并收集干燥纯净的NH3 |
B、 用此图装置实验室制备Fe(OH)2 |
C、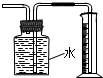 此图装置收集并测量Cu与浓硝酸反应产生的气体及体积 |
D、 此图装置可用于实验室制取乙酸乙酯 |
设NA代表阿伏伽德罗常数,下列对于0.3mol/L的K2SO4溶液的说法不正确的是( )
A、2L溶液中含有0.6NA个S
| ||
| B、2L溶液中K+离子的浓度为1.2mol/L | ||
| C、1L溶液中含K+离子的质量是23.4g | ||
| D、1L溶液中含溶质阴阳离子的总数为0.9NA个 |
下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A、Fe2+、H+、NO3-、Cl- |
| B、Na+、H+、SO42-、ClO- |
| C、Ca2+、Na+、CO32-、NO3- |
| D、Fe3+、SO42-、SCN-、Na+ |
已知A、B、C、D、E是短周期元素,原子序数依次增大.其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A、B位于元素周期表中第二周期第 VIA族 |
| B、工业上常用电解法制备C、D、E的单质 |
| C、B、D的最高价氧化物对应的水化物之间能发生化学反应 |
| D、化合物AE与CE具有相同类型的化学键 |
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中) 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0).
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0).