题目内容
7.青蒿素在一定条件下可以合成双氢青蒿素,关于青蒿素和双氢青蒿素(结构如图)的下列说法中,错误的是( )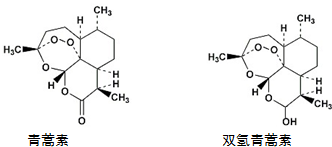
| A. | 青蒿素能发生还原反应 | |
| B. | 双氢青蒿素发生酯化反应和氧化反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
分析 A.青蒿素中含有过氧键,具有强氧化性;
B.双氢青蒿素中含有醇羟基、醚键和过氧键,具有醇、醚和过氧化物的性质;
C.青蒿素分子中含有酯基、醚键和过氧键;
D.双氢青蒿素分子中共含有5个环,其中有3个六元环(1个六碳环、1个五碳一氧环、1个三碳三氧环)和2个七元环(1个六碳一氧环、1个五碳二氧环).
解答 解:A.青蒿素中含有过氧键,具有强氧化性,所以能发生还原反应,故A正确;
B.双氢青蒿素中含有醇羟基、醚键和过氧键,具有醇、醚和过氧化物的性质,醇羟基能发生氧化反应和酯化反应,故B正确;
C.青蒿素分子中含有酯基、醚键和过氧键,故C正确;
D.双氢青蒿素分子中共含有5个环,其中有3个六元环(1个六碳环、1个五碳一氧环、1个三碳三氧环)和2个七元环(1个六碳一氧环、1个五碳二氧环),故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及知识迁移能力,明确官能团及其性质关系是解本题关键,注意过氧键的性质,题目难度不大.

练习册系列答案
相关题目
15.盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是( )
| A. | NaHCO3溶液中存在:c(OH-)═c (H+)+c (H2CO3) | |
| B. | 25℃时,将pH=2的盐酸与pH=12的氨水混合后,溶液呈中性,则消耗溶液的体积:V(盐酸)<V(氨水) | |
| C. | pH相等的盐酸和CH3COOH溶液稀释到相同的pH,盐酸稀释的倍数大 | |
| D. | 将0.2mol/L的NaHCO3溶液和0.1mol/L的醋酸钠溶液等体积混合,溶液中存在:c(Na+)═c(CH3COOH)+c(CH3COO-)+c(CO32-)+c(HCO3-)+c(H2CO3) |
2.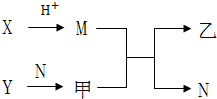 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | A、C、D的常见氧化物相互之间一定能反应 | |
| B. | 相对分子质量M>N,沸点N>M | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
19.下列有关物质结构的说法正确的是( )
| A. | 电子层数多的原子的半径一定大于电子层数少的原子的半径 | |
| B. | P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条 | |
| C. | H2SO3酸性强于H2CO3,所以非金属性S大于C | |
| D. | 不同原子形成的化合物中一定只含极性键 |
16.加入Na2O2一定不会出现浑浊的是( )
| A. | 饱和NaHCO3溶液 | B. | Ca(HCO3)2溶液 | C. | Na2S溶液 | D. | AlCl3溶液 |
17.温度相同,浓度均为0.2mol•L-1的下列溶液:①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤NaClO,⑥CH3COONa.它们的pH由小到大的排列顺序是( )
| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
