题目内容
17.温度相同,浓度均为0.2mol•L-1的下列溶液:①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤NaClO,⑥CH3COONa.它们的pH由小到大的排列顺序是( )| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
分析 先将①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤NaClO⑥CH3COONa分为三部分:显示酸性、中性和碱性,溶液的pH一定满足:酸性<中性<碱性;若同为酸性或碱性时,根据电离、水解程度判断酸性、碱性相对强弱,如:⑥⑤显示碱性,由于⑤中次氯酸根离子的水解程度大于⑥中醋酸根离子的水解程度,则碱性⑤>⑥,据此进行解答.
解答 解:①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤NaClO⑥CH3COONa六种溶液中,②呈中性,①③④显示酸性,①中铵根离子浓度最大,酸性最强,③中氢离子的存在抑制铵根离子的水解,④中铵根离子的水解不受影响,则三种溶液的pH大小为:③<①<④;
⑥⑤显示碱性,⑤中次氯酸根离子的水解程度大于⑥中醋酸根离子的水解程度,则碱性:⑤>⑥,则溶液的pH:⑤>⑥,
所以它们的pH值由小到大的排列顺序为:③①④②⑥⑤,
故选A.
点评 本题考查溶液pH大小比较、盐的水解原理及其应用,题目难度中等,明确盐的水解原理为解答关键,注意熟练掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.青蒿素在一定条件下可以合成双氢青蒿素,关于青蒿素和双氢青蒿素(结构如图)的下列说法中,错误的是( )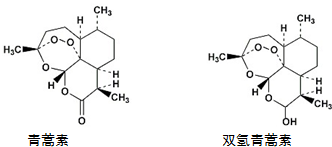

| A. | 青蒿素能发生还原反应 | |
| B. | 双氢青蒿素发生酯化反应和氧化反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
5.A、B、C、D 均为气体,对于A+3B?2C+D 的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A)=0.4 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |
12.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | pH=2的醋酸用水稀释至原体积10倍后,溶液中H+的数目大于0.001NA | |
| C. | 常温常压下,92g NO2和N2O4的混合气体含有的氧原子数为4NA | |
| D. | 500mL0.2mol•L-1的MgSO4溶液中,SO42-所带负电荷数为0.1NA |
9.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 苯和水 | B. | 酒精和溴水 | C. | 苯和溴苯 | D. | 水和NaCl |
6.下列离子方程式书写正确的是( )
| A. | 等物质的量的Ba(OH)2与明矾[KAl(SO4)2•12H2O]加入足量水中:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 在AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
7.短周期元素X、Y、Z、W、Q在周期表中相对位置如图所示,已知X元素是地壳中含量最高的元素,下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | Y的非金属性比Q强,所以HnY的酸性比HnQ强 | |
| B. | ZX2、WX2的熔沸点、硬度相差很大,这是由于它们的化学键类型不同造成的 | |
| C. | W、Q、Y元素的原子半径及其简单离子半径依次减小 | |
| D. | 将足量的X单质通入W的氢化物的水溶液,能得到W的低价氧化物 |

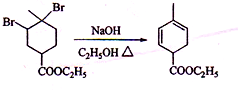 .
.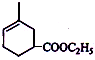 .
.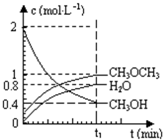 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题: